- Основное
- Наличие в аптеках
- Инструкция
- Написать отзыв
Вабисмо раствор для инъекций по 120 мг/мл по 0,24 мл во флаконе, 1 шт.
Ожидается

Аллергикам | |
Беременным | |
Кормящим матерям | |
Детям | |
Температура хранения | |
Рецептурный отпуск |
Свойства препарата Вабисмо раствор для инъекций по 120 мг/мл по 0,24 мл во флаконе, 1 шт.
Основные
| Действующее вещество | |
| Торговое название | Вабисмо |
| Категория | |
| GTIN | 7613326079419 |
| Страна производитель | Швейцария |
| Импортный | Да |
| Упаковка | По 0,24 мл во флаконе, по 1 флакону в картонной упаковке |
| Код Морион | 876229 |
| Температура хранения | от 2 °С до 8 °С |
| Рецептурный отпуск | по рецепту |
| Форма выпуска | Раствор |
| Кол-во в упаковке | 1 |
| Срок годности | 2,5 года |
| Объем | 0,24 мл |
| Производитель |
Кому можна
| Аллергикам | с осторожностью |
| Беременным | с осторожностью |
| Кормящим матерям | с осторожностью |
| Детям | запрещено |
Перед публикацией Ваш отзыв может быть отредактирован для исправления грамматики, орфографии или удаления неприемлемых слов и контента. Отзывы, которые, как нам кажется, созданы заинтересованными сторонами, не будут опубликованы. Старайтесь рассказывать о собственном опыте, избегая обобщений.
Вабисмо раствор для инъекций по 120 мг/мл по 0,24 мл во флаконе, 1 шт. - Инструкция по применению
Состав
1 флакон содержит 28,8 мг фарицимаба в 0,24 мл раствора, что соответствует концентрации 120 мг/мл;
разовая доза – 6 мг/0,05 мл;
другие составляющие: L-гистидин, кислота уксусная 30 %, L-метионин, натрия хлорид, D-сахароза, полисорбат 20, вода для инъекций.
Лекарственная форма
Основные физико-химические свойства: прозрачная или опалесцирующая жидкость, бесцветного или коричневато-желтого цвета.
Фармакотерапевтическая группа
Код ATX S01L A09.
Фармакодинамика
Фарицимаб є гуманізованим біспецифічним антитілом IgG1, що діє через пригнічення двох окремих шляхів передачі сигналу за рахунок нейтралізації як Ang-2 (ангіопоетин-2), так і фактора росту ендотелію судин A (VEGF-A). Ang-2 спричиняє васкулярну нестабільність шляхом стимуляції дестабілізації ендотелію, втрати перицитів і патологічного ангіогенезу, потенціюючи таким чином випотівання рідини через судини і запалення. Ang-2 також сенсибілізує кровоносні судини до дії VEGF-A, що призводить до подальшої васкулярної дестабілізації. Ang-2 і VEGF-A синергічно збільшують проникність судин і стимулюють неоваскуляризацію. Шляхом подвійного пригнічення Аng-2 і VEGF-A фарицимаб зменшує проникність судин і запалення, інгібує патологічний ангіогенез і відновлює васкулярну стабільність.
У описаних нижче чотирьох клінічних дослідженнях III фази було виявлено супресію середньої концентрації вільного ANG-2 і вільного VEGF-A в органах зору, починаючи з дня 7, порівняно із вихідним рівнем.
Неоваскулярна (ексудативна) вікова макулярна дегенерація (нВМД)
Подібне при застосуванні афліберцепту зменшення середньої товщини центру фовеолярної зони (товщина центрального підполя, CST) спостерігалося, починаючи з вихідного рівня по 48 тиждень під час застосування препарату Вабісмо. Середнє зменшення CST від вихідного рівня до візитів для оцінки первинної кінцевої точки (усереднено на 40, 44 і 48 тижнях) становило -137 мкм і -137 мкм для препарату Вабісмо з інтервалом введення 8 тижнів (кожні 8 тижнів), 12 тижнів (кожні 12 тижнів) або 16 тижнів (кожні 16 тижнів) порівняно із -129 мкм і -131 мкм при застосуванні афліберцепту в дослідженнях TENAYA і LUCERNE відповідно. Tаке середнє зменшення CST підтримувалось впродовж року 2. Спостерігався порівнянний ефект препаратів Вабісмо і афліберцепту щодо зменшення інтраретинальної рідини (IRF), субретинальної рідини (SRF) і відшарування пігментного епітелію (ВПЕ). Під час візитів для оцінки первинної кінцевої точки в дослідженнях TENAYA і LUCERNE частка пацієнтів із відсутністю IRF становила відповідно 76–82 % і 78–85 % при лікуванні препаратом Вабісмо порівняно з 74–85 % та 78–84 % при лікуванні афліберцептом. Відсоток пацієнтів із відсутністю SRF у двох дослідженнях становив 70–79 % і 66–78 % при лікуванні препаратом Вабісмо порівняно з 66–78 % і 62–76 % при лікуванні афліберцептом. Відсоток пацієнтів із відсутністю ВПЕ у двох дослідженнях становив 3–8 % і 3–6 % при лікуванні препаратом Вабісмо порівняно з 8–10 % та 7–9 % при лікуванні афліберцептом. Таке зменшення IRF, SRF і ВПЕ підтримувалось впродовж року 2 (тижні 104–108).
На 48 тижні порівнянні зміни від вихідного рівня показника загальної площі ураження, спричиненого хоріоїдальною неоваскуляризацією (CNV), і порівнянне зменшення зони випотівання CNV з екскрецією крові та рідини спостерігалися в обох дослідженнях у пацієнтів, які отримували лікування препаратом Вабісмо та афліберцептом.
Діабетичний макулярний набряк (ДМН)
Зниження середнього значення CST від вихідного рівня, що спостерігалося в дослідженнях YOSEMITE і RHINE, було чисельно більшим у пацієнтів, які отримували лікування препаратом Вабісмо з інтервалом кожні 8 тижнів та з інтервалом до кожних 16 тижнів коригованого дозування, порівняно з тими, хто отримував Афлиберцепт каждые 8 недель у період з 4 по 100 тиждень. В обох дослідженнях у більшої частки пацієнтів у групах препарату Вабісмо з часом було досягнуто відсутності IRF і відсутності ДМН (визначено як досягнення CST менше 325 мкм за результатами оптичної когерентної томографії [ОКТ]) порівняно з групою афліберцепту. Порівнянне зменшення SRF з часом спостерігалося в групах лікування препаратами Вабісмо і афліберцептом в обох дослідженнях. Середнє зниження CST від вихідного рівня до візитів для оцінки первинної кінцевої точки (усереднено на 48, 52 і 56 тижнях) у дослідженні YOSEMITE становило 207 мкм і 197 мкм у пацієнтів, які отримували лікування препаратом Вабісмо з інтервалом кожні 8 тижнів та з інтервалом до кожних 16 тижнів коригованого дозування, порівняно зі 170 мкм у пацієнтів, які отримували лікування афліберцептом кожні 8 тижнів; у дослідженні RHINE результати становили 196 мкм, 188 мкм і 170 мкм відповідно. Таке зменшення середнього значення CST зберігалося до 2 року. Частка пацієнтів із відсутністю ДМН під час візитів для оцінки первинної кінцевої точки (мінімальне/максимальне значення) в дослідженні YOSEMITE становила 77–87 % і 80–82 % у групі лікування препаратом Вабісмо з інтервалом кожні 8 тижнів і з інтервалом до кожних 16 тижнів коригованого дозування відповідно порівняно з 64–71 % у групі лікування афліберцептом кожні 8 тижнів; у дослідженні RHINE результати становили 85–90 %, 83–87 % і 71–77 % відповідно. Ці результати зберігались до 2 року.
У дослідженні YOSEMITE частка пацієнтів із відсутністю IRF під час візитів для оцінки первинної кінцевої точки (усереднено на 48, 52 і 56 тижнях) становила 42–48 % і 34–43 % у групі лікування препаратом Вабісмо з інтервалом кожні 8 тижнів і з інтервалом до кожних 16 тижнів коригованого дозування відповідно порівняно з 22–25 % у групі лікування афліберцептом кожні 8 тижнів; у дослідженні RHINE результати становили 39–43 %, 33–41 % і 23–29 % відповідно. Ці результати зберігалися до 2 року.
Клінічна ефективність та безпека
Лікування нВМД
Ефективність та безпека застосування фарицимабу порівняно з анти-VEGF лікуванням вивчалися в двох рандомізованих (1:1) багатоцентрових подвійно сліпих дослідженнях з двома групами (TENAYA і LUCERNE) за участю пацієнтів із нВМД. Лікування (фарицимаб, 6 мг, або афліберцепт, 2 мг) проводилося шляхом інтравітреальної ін’єкції початково із 4-тижневими інтервалами. В групі афліберцепту після 3 початкових ін’єкцій інтервал між введеннями становив 8 тижнів до кінця дослідження (кожні 8 тижнів). У групі фарицимабу інтервал між введеннями було скориговано індивідуально після 4 початкових доз. Заключний (фіксований) інтервал між введеннями становив 8 тижнів (кожні 8 тижнів), 12 тижнів (кожні 12 тижнів) або максимум 16 тижнів (кожні 16 тижнів) залежно від встановленої протоколом зміни CST, визначеної за результатами спектральної оптичної когерентної томографії та/або зміни BCVA, визначеної за кількістю літер за дослідженням ефективності раннього лікування діабетичної ретинопатії (ETDRS), a також від клінічної оцінки лікарем наявності/відсутності крововиливу в жовту пляму на 20 і 24 тижні. Починаючи з тижня 60 і далі, пацієнти групи лікування Вабісмо були переведені на гнучкий режим дозування, відповідно до якого інтервал між введеннями можна було збільшувати з кроком до 4 тижнів (до кожних 16 тижнів) або можна було зменшувати з кроком до 8 тижнів (до кожних 8 тижнів) на основі автоматизованої об’єктивної оцінки попередньо визначених критеріїв візуальної та анатомічної активності захворювання. Пацієнти в групі афліберсепту продовжували отримувати режим дозування кожні 8 тижнів протягом усього періоду дослідження. Обидва дослідження тривали 112 тижнів.
Дослідження включали загалом 1329 раніше нелікованих пацієнтів, при цьому 1135 (85 %) пацієнтів завершили дослідження до тижня 112. Загалом 1326 пацієнтів отримали щонайменше одну дозу (включно з 664 пацієнтами групи фарицимабу). Середній вік [діапазон віку] досліджуваної популяції становив 75,9 року [від 50 до 99 років]. Первинною кінцевою точкою ефективності була середня зміна BCVA від вихідного рівня (на основі середнього значення протягом 40, 44 і 48 тижнів), визначена за допомогою таблиці літер ETDRS з відстані 4 метри. В обох дослідженнях первинна гіпотеза (не менша ефективність) була підтверджена: пацієнти, які отримували лікування препаратом Вабісмо з інтервалом до кожних 16 тижнів, і пацієнти, які отримували лікування афліберцептом кожні 8 тижнів, продемонстрували порівнянну середню зміну BCVA від відповідного вихідного показника через 1 рік. Значне покращення зору від вихідного стану відмічалось до тижня 112 в обох групах лікування. Детальні результати обох досліджень наведено в таблицях 1 і 2, а також на рисунку 1.
Частка пацієнтів в групах персоналізованих інтервалів введення препарату на 48 тижні в дослідженнях TENAYA і LUCERNE відповідно становила: кожні 16 тижнів – 46 %, 45 %; кожні 12 тижнів – 34 %, 33 %; кожні 8 тижнів – 20 %, 22 %.
Частка пацієнтів в групах персоналізованих інтервалів введення препарату на 112 тижні в дослідженнях TENAYA і LUCERNE відповідно становила: кожні 16 тижнів – 59 %, 67 %; кожні 12 тижнів – 15 %, 14 %; кожні 8 тижнів – 26 %, 19 %.
Tаблиця 1
Результати щодо ефективності під час візитів для оцінки первинної кінцевої точкиа через 2 рокиb в дослідженні TENAYA
Результати щодо ефективності |
TENAYA |
|||
Год 1 |
Год 2 |
|||
Вабісмо, інтервал введення до кожних 16 тижнів, N = 334 |
Афліберцепт кожні 8 тижнів, N = 337 |
Вабісмо, інтервал введення до кожних 16 тижнів, N = 334 |
Афліберцепт кожні 8 тижнів, N = 337 |
|
Середня зміна BCVA від вихідного показника за результатами визначення кількості літер за ETDRS (95 % ДІ) |
5,8 (4,6, 7,1) |
5,1 (3,9, 6,4) |
3,7 (2,1, 5,4) |
3,3 (1,7, 4,9) |
Частка пацієнтів зі збільшенням розпізнавання на ≥ 15 літер від вихідного рівня (зважена частка за CMH, 95 % ДІ) |
20 % (15,6 %, 24,4 %) |
15,7 % (11,9 %, 19,6 %) |
22,5 % (17,8 %, 27,2 %) |
16,9 % (12,7 %, 21,1 %) |
Частка пацієнтів, які уникнули зменшення розпізнання на ≥ 15 літер від вихідного рівня (зважена частка за CMH, 95 % ДІ) |
95,4 % (93 %, 97,7 %) |
94,1 % (91,5 %, 96,7 %) |
92,1 % (89,1 %, 95,1 %) |
88,6 % (85,1 %, 92,2 %) |
a Среднее недель 40, 44 і 48.
b Среднее недель 104, 108, 112.
BVCA – найкраща скоригована гострота зору; ETDRS – дослідження ефективності раннього лікування діабетичної ретинопатії; ДІ – довірчий інтервал; СMH – метод Кокрана – Мантеля – Хензеля, статистичний тест, який генерує оцінку зв’язку з бінарним результатом і використовується для оцінки категоріальних змінних.
Tаблиця 2
Результати щодо ефективності під час візитів для оцінки первинної кінцевої точкиа через 2 рокиb в дослідженні LUCERNE
Результаты эффективности |
LUCERNE |
|||
Год 1 |
Год 2 |
|||
Вабисмо, интервал введения до каждые 16 недель, N = 331 |
Афлиберцепт каждые 8 недель, N = 327 |
Вабисмо, интервал введения до каждые 16 недель, N = 331 |
Афлиберцепт каждые 8 недель, N = 327 |
|
Среднее изменение BCVA от исходного показателя по результатам определения количества букв по ETDRS (95% ДИ) |
6,6 (5,3, 7,1) |
6,6 (5,3, 7,8) |
5,0 (3,4, 6,6) |
5,2 (3,6, 6,8) |
Доля пациентов с увеличением распознавания на ≥15 букв от исходного уровня (взвешенная доля по CMH, 95% ДИ) |
20,2 % (15,9 %, 24,6 %) |
22,2 % (17,7 %, 26,8 %) |
22,4 % (17,8 %, 27,1 %) |
21,3 % (16,8 %, 25,9 %) |
Доля пациентов, избежавших уменьшения распознавания на ≥15 букв от исходного уровня (взвешенная доля по CMH, 95% ДИ) |
95,8 % (93,6 %, 98,0 %) |
97,3 % (95,5 %, 99,1 %) |
92,9 % (90,1 %, 95,8 %) |
93,2 % (90,2 %, 96,2 %) |
a Среднее недель 40, 44 і 48.
b Среднее недель 104, 108, 112.
BVCA – лучшая скорректированная острота зрения; ETDRS – исследование эффективности раннего лечения диабетической ретинопатии; ДИ – доверительный интервал; СMH – метод Кокрана – Мантеля – Хензеля, статистический тест, генерирующий оценку связи с бинарным результатом и используемый для оценки категориальных переменных.
Скорректированное среднее изменение исходного показателя |
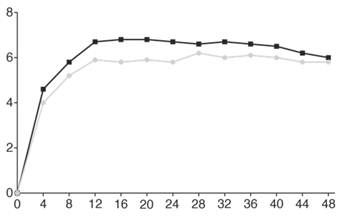 |
Недели
 Фарицимаб, 6 мг, до каждые 16 недель (N = 665)
Фарицимаб, 6 мг, до каждые 16 недель (N = 665) Афлиберцепт, 2 мг, каждые 8 недель (N = 664)
Афлиберцепт, 2 мг, каждые 8 недель (N = 664)Рис. 1.Объединенные исследования III фазы нВМД (TENAYA и LUCERNE): график изменения BCVA от исходного уровня в исследуемом глазу до 112 недели, метод MMRM (первичная оценка) (популяция ITT)
В обоих исследованиях TENAYA и LUCERNE улучшение BCVA и CST от исходного уровня на 60 неделе было сравнимо в двух группах лечения и совпадало с тем, что наблюдалось на 48 неделе.
Результаты эффективности во всех подгруппах пациентов (например, по возрасту, полу, этническому происхождению, исходной остроте зрения, типу поражения, размеру поражения) в каждом исследовании и в совокупном анализе совпадали с результатами в общей популяции.
В обоих исследованиях препарат Вабисмо, который вводили с интервалом до каждые 16 недель, продемонстрировал клинически значимое улучшение от исходного уровня до 48 недели суммарного индекса по опроснику для оценки зрительной функции Национального офтальмологического института США (NEI VFQ-25), сравнимого с таким при применении афлиберцепта каждые 8 недель. У пациентов в группах лечения препаратом Вабисмо в исследованиях TENAYA и LUCERNE было достигнуто улучшение суммарного индекса по NEI VFQ-25 на ≥4 балла от исходного показателя на 48 неделе. Такое улучшение сохранялось до 112 недель.
Лечение ДМН
Безопасность и эффективность применения фарицимаба по сравнению с анти-VEGF лечением изучались в двух рандомизированных (1:1:1) многоцентровых двойно слепых исследованиях с тремя группами (YOSEMITE и RHINE) продолжительностью 2 года при участии пациентов с ДМН. инъекции фарицимаба по 6 мг каждые 8 недель (после 6 ежемесячных инъекций в начале лечения), фарицимаб по 6 мг с персонализированным интервалом между инъекциями максимум до 16 недель (после 4 ежемесячных инъекций в начале лечения) или афлиберцепт по 2 мг недель (после 5 ежемесячных инъекций в начале лечение).
В группе фарицимаба с удлиненным интервалом между введением до каждые 16 недель дозировка препарата выполнялась по стандартизированной схеме лечения с продолжением интервалов между введениями доз препарата. интервал между инъекциями в группе Фарицимаб может быть продлен на 4 нед или сокращен на 4 или 8 недель во время каждого визита лекарственного средства (см. раздел «Способ применения и дозы»).
В исследование было включено в общей сложности 1891 пациента (из которых примерно 94% имели сахарный диабет 2 типа), 1622 (85,8%) пациенты завершили участие в исследовании до недели 100. Всего 1887 пациентов получили по меньшей мере одну дозу до недели 56 (1262 пациента получили препарат Вабисмо). испытуемых пациентов составлял 62,2 года [от 24 до 91 года].
Первичной конечной точкой эффективности было среднее изменение показателя BCVA от исходного уровня до конца первого года (среднее 48, 52 и 56 недель), определенное с помощью таблицы букв ETDRS с расстояния 4 метра. обеих групп лечения: пациенты, получавшие препарат Вабис каждые 8 ¦недель, и пациенты, получавшие препарат Вабисмо в режиме удлиненного интервала между введениями до каждых 16 недель, имели сравнительное среднее изменение показателя BCVA от исходного уровня, как и пациенты, получавшие лечение афлиберцептом каждые 8 недель, через 1 год, и это улучшение зрения сохранялось до 2 лет.
После 4 начальных ежемесячных введений пациенты из группы препарата Вабисмо с корректированным интервалом введений до каждых 16 недель могли получить в общей сложности по меньшей мере 6 и максимум 21 инъекцию до 96 недели. соответствующих группах препарата Вабисмо с корректируемым режимом дозирования каждые 16 недель достигнут интервал между введениями каждые 16 или 12 недель (53% и 51% – каждые 16 недель, 21% и 20% – каждые 12 недель). сохранялся интервал между введением каждые ≥12 недель без сокращения этого интервала менее 12 недель до 96 недели; недели в обоих исследованиях у 78% пациентов соответствующей группы лечения препаратом Вабисмо с корректированным режимом введения каждые 16 недель достигнута частота введения каждые 16 или каждые 12 недель (60% и 65% пациентов – каждые 16 недель, 18% и 14% пациентов – каждые 12 недель). исследованиях YOSEMITE и RHINE соответственно интервал было продлено до 8 недель и пациенты продолжили получать препарат с интервалом введения каждые 8 недель до 96 недели; 3% и 5% получали препарат с режимом введения каждые 4 недели до конца 96 недели.
Таблица 3
Результаты эффективности во время визитов для оценки первичной конечной точки в 1a и на 2b года в исследовании YOSEMITE
Результаты эффективности |
YOSEMITE |
|||||
1 год |
2 года |
|||||
Вабис каждые 8 недель, N = 315 |
Вабиссо с корректированным режимом дозирования до каждые 16 недель, N = 313 |
Афлиберцепт каждые 8 недель, N = 312 |
Вабис каждые 8 недель, N = 262 |
Вабиссо с корректированным режимом дозирования до каждые 16 недель, N = 270 |
Афлиберцепт каждые 8 недель, N = 259 |
|
Среднее изменение от исходного уровня показателя BCVA по результатам определения количества букв по ETDRS (97,5% ДИ в 1 год и 95% на 2 год) |
10,7 (9,4, 12,0) |
11,6 (10,3, 12,9) |
10,9 (9,6, 12,2) |
10,7 (9,4, 12,1) |
10,7 (9,4, 12,1) |
11,4 (10,0, 12,7) |
Доля пациентов, у которых BCVA увеличилась по меньшей мере на 15 букв от исходного уровня (взвешенная доля по CMH, 95% ДИ в 1 и 2 год) |
29,2 % (23,9 %, 34,5 %) |
35,5 % (30,1 %, 40,9 %) |
31,8 % (26,6 %, 37,0 %) |
37,2 % (31,4 %, 42,9 %) |
38,2 % (32,8 %, 43,7 %) |
37,4 % (31,7 %, 43,0 %) |
Доля пациентов, избежавших уменьшения BCVA по меньшей мере на 15 букв от исходного уровня (взвешенная доля по CMH, 95% ДИ в 1 и 2 год) |
98,1 % (96,5 %, 99,7 %) |
98,6 % (97,2 %, 100,0 %) |
98,9 % (97,6 %, 100,0 %) |
97,6 % (95,7 %, 99,5 %) |
97,8 % (96,1 %, 99,5 %) |
98,0 % (96,2 %, 99,7 %) |
a Среднее недель 48, 52, 56.
b Среднее недель 92, 96, 100.
BVCA – лучшая скорректированная острота зрения; ETDRS – исследование эффективности раннего лечения диабетической ретинопатии; ДИ – доверительный интервал; CMH – метод Кокрана – Мантеля – Хензеля, статистический тест, генерирующий оценку связи с бинарным результатом и используемый для оценки категориальных переменных.
Примечание: данные относительно CMH-взвешенного %, продемонстрированные для группы афлиберцепта, предназначены для сравнения между дозировкой препарата Вабис каждые 8 недель и афлиберцепта, однако соответствующий CMH-взвешенный % для сравнения корректированного режима препарата Вабисмо с афлиберцептом сходен.
ETDRS-DRSS: шкала тяжести диабетической ретинопатии по исследованию эффективности раннего лечения диабетической ретинопатии (шкала оценки диабетической ретинопатии по исследованию эффективности раннего лечения диабетической ретинопатии).
Таблица 4
Доля пациентов с улучшением ETDRS-DRSS на ≥ 2 степени на 52 и 96 неделях по сравнению с исходным состоянием в исследовании YOSEMITE (оцениваемая популяция по диабетической ретинопатии)
Результаты эффективности |
YOSEMITE |
|||||
52 недели |
96 недель |
|||||
Вабис каждые 8 недель, n = 237 |
Вабис с корректированным режимом дозирования до каждые 16 недель, n = 242 |
Афлиберцепт каждые 8 недель, n = 229 |
Вабис каждые 8 недель, n = 220 |
Вабис с корректированным режимом дозирования до каждые 16 недель, n = 234 |
Афлиберцепт каждые 8 недель, n = 221 |
|
Частка пацієнтів із покращенням на ≥ 2 ступеня від вихідного рівня за шкалою ETDRS-DRSS (зважена частка за CMH) |
46,0 % |
42,5 % |
35,8 % |
51,4 % |
42,8 % |
42,2 % |
ETDRS-DRSS – шкала тяжести диабетической ретинопатии по исследованию эффективности раннего лечения диабетической ретинопатии.
ДИ – доверительный интервал; CMH – метод Кокрана – Мантеля – Хензеля, статистический тест, генерирующий оценку связи с бинарным результатом и используемый для оценки категориальных переменных.
Примечание: данные относительно CMH-взвешенного %, продемонстрированные для группы афлиберцепта, предназначены для сравнения между дозировкой препарата Вабис каждые 8 недель и афлиберцепта, однако соответствующий CMH-взвешенный % для сравнения корректированного режима препарата Вабисмо с афлиберцептом сходен.
Таблица 5
Результаты эффективности во время визитов для оценки первичной конечной точки в 1a и на 2b года в исследовании RHINE
Результаты эффективности |
RHINE |
|||||
1 год |
2 года |
|||||
Вабисмо каждые 8 недель, N = 317 |
Вабис с корректированным режимом дозирования до каждые 16 недель, N = 319 |
Афлиберцепт каждые 8 недель, N = 315 |
Вабисмо каждые 8 недель, N = 259 |
Вабис с корректированным режимом дозирования до каждые 16 недель, N = 282 |
Афлиберцепт каждые 8 недель, N = 254 |
|
Среднее изменение исходного уровня показателя BCVA по результатам определения количества букв по ETDRS (97,5 % ДИ в 1 год и 95 % на 2 год) |
11,8 (10,6, 13,0) |
10,8 (9,6, 11,9) |
10,3 (9,1, 11,4) |
10,9 (9,5, 12,3) |
10,1 (8,7, 11,5) |
9,4 (7,9, 10,8) |
Доля пациентов, у которых BCVA увеличилась по меньшей мере на 15 букв от исходного уровня (взвешенная доля по CMH, 95% ДИ в 1 и 2 год)) |
33,8 % (28,4 %, 39,2 %) |
28,5 % (23,6 %, 33,3 %) |
30,3 % (25,0 %, 35,5 %) |
39,8 % (34,0 %, 45,6 %) |
31,1 % (26,1 %, 36,1 %) |
39,0 % (33,2 %, 44,8 %) |
Доля пациентов, избежавших уменьшения BCVA по меньшей мере на 15 букв от исходного уровня (взвешенная доля по CMH, 95% ДИ в 1 и 2 год)) |
98,9 % (97,6 %, 100,0 %) |
98,7 % (97,4 %, 100,0 %) |
98,6 % (97,2 %, 99,9 %) |
96,6 % (94,4 %, 98,8 %) |
96,8 % (94,8 %, 98,9 %) |
97,6 % (95,7 %, 99,5 %) |
a Среднее недель 48, 52, 56.
b Среднее недель 92, 96, 100.
BVCA – лучшая скорректированная острота зрения; ETDRS – исследование эффективности раннего лечения диабетической ретинопатии; ДИ – доверительный интервал; CMH – метод Кокрана – Мантеля – Хензеля, статистический тест, генерирующий оценку связи с бинарным результатом и используемый для оценки категориальных переменных.
Примечание: данные по CMH-взвешенному %, продемонстрированные для группы афлиберцепта, предназначены для сравнения между дозировкой препарата Вабисмо каждые 8 недель и афлиберцепта, однако соответствующий CMH-взвешенный % для сравнения корректированного режима препарата Вабисмо с афлиберцептом сходен с указанным выше.
ETDRS-DRSS – шкала тяжести диабетической ретинопатии по исследованию эффективности раннего лечения диабетической ретинопатии (шкала оценки диабетической ретинопатии по исследованию эффективности раннего лечения диабетической ретинопатии).
Таблица 6
Доля пациентов с улучшением ETDRS-DRSS на ≥ 2 степени на 52 и 96 неделях по сравнению с исходным состоянием в исследовании RHINE (оцениваемая популяция по диабетической ретинопатии)
Результаты эффективности |
RHINE |
|||||
52 недели |
96 недель |
|||||
Вабисмо каждые 8 недель, n = 237 |
Вабисмо с корректированным режимом дозирования до каждые 16 недель, n = 242 |
Афлиберцепт каждые 8 недель, n = 229 |
Вабисмо каждые 8 недель, n = 220 |
Вабисмо с корректированным режимом дозирования до каждые 16 недель, n = 234 |
Афлиберцепт каждые 8 недель, n = 221 |
|
Доля пациентов с улучшением на ≥2 степени по шкале ETDRS-DRSS от исходного уровня (взвешенная доля по CMH) |
44,2 % |
43,7 % |
46,8 % |
53,5 % |
44,3 % |
43,8 % |
ETDRS – исследование эффективности раннего лечения диабетической ретинопатии
ДИ – доверительный интервал; CMH – метод Кокрана – Мантеля – Хензеля, статистический тест, генерирующий оценку связи с бинарным результатом и используемый для оценки категориальных переменных.
Примечание: данные по CMH-взвешенному %, продемонстрированные для группы афлиберцепта, предназначены для сравнения между дозировкой препарата Вабисмо каждые 8 недель и афлиберцепта, однако соответствующий CMH-взвешенный % для сравнения корректированного режима препарата Вабисмо с афлиберцептом сходен с указанным выше.
Скорректированное среднее изменение исходного показателя |
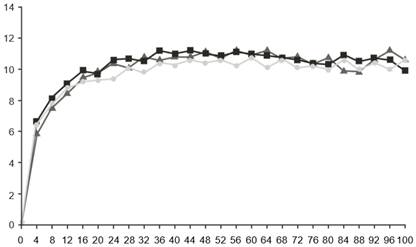 |
Недели
 Фарицимаб, 6 мг, каждые 16 недель корректированной дозировки (N = 632)
Фарицимаб, 6 мг, каждые 16 недель корректированной дозировки (N = 632) Фарицимаб, 6 мг, каждые 8 недель (N=632)
Фарицимаб, 6 мг, каждые 8 недель (N=632) Афлиберцепт, 2 мг, каждые 8 недель (N=627)
Афлиберцепт, 2 мг, каждые 8 недель (N=627)Рис. 2. Объединенные исследования II фазы ДМН (YOSEMITE и RHINE): график изменения BCVA от исходного уровня в исследуемом глазу до недели 100: метод MMRM (первичная оценка) (популяция ITT)
Результаты эффективности у пациентов, не получавших анти-VEGF лечения для участия в этом исследовании, и во всех других подгруппах пациентов, подлежащих оценке (в частности, по возрасту, полу, этническому происхождению, исходному уровню HbA1c, исходному показателю остроты зрения), в каждом исследовании совпадали с результатами в соответствующей популяции.
Эффект лечения не зависел от гликемического контроля, и сравнимые результаты были достигнуты при лечении фарицимабом пациентов с улучшением или ухудшением со временем уровня HbA1c на >0,5% или оставался в пределах 0,5% от исходного уровня.
Пациенты пожилого возраста
В четырех клинических исследованиях III фазы примерно 60% (1149/1929) пациентов, рандомизированных для лечения препаратом Вабисмо, были старше 65 лет. Популяционный фармакокинетический анализ показал влияние возраста на фармакокинетику фарицимаба в органе зрения, расцененного как клинически незначительное (см. раздел «Способ применения и дозы», «Фармакокинетика»).
Иммуногенность
Существует потенциал для развития иммунного ответа у пациентов, получающих лечение препаратом Вабисмо (см. раздел «Особенности применения»).
После введения препарата Вабисмо до 48 (нВМД) и 100 (ДМН) недель антитела к фарицимабу, образовавшихся во время лечения, были обнаружены примерно у 10% пациентов. Клиническое значение антител к фарицимабу по безопасности до сих пор неизвестно. У пациентов с антителами к фарицимабу наблюдалась более высокая частота побочных реакций в виде внутриглазного воспаления. Однако общая частота обнаружения антител к фарицимабу и внутриглазному воспалению во всей исследуемой популяции составляет примерно 1%. Антитела к фарицимабу не ассоциировались с влиянием на клиническую эффективность или системную фармакокинетику.
Фармакокинетика
Препарат Вабисмо вводится интравитреально для оказания местного воздействия на глаз. Клинические исследования других путей введения не проводились.
По данным популяционного фармакокинетического анализа (включая нВМД и ДМН, N = 2246), максимальная концентрация в плазме крови (Cmax) свободного (несвязанного с VEGF-A и Ang-2) фарицимаба по расчетам достигается через 2 дня после введения. Среднее (± стандартное отклонение) Cmax в плазме крови свободной формы рассчитано на уровне 0,23 (0,07) мкг/мл и 0,22 (0,07) мкг/мл соответственно у пациентов с нВМД и ДМН/диабетической ретинопатией (ДР) ). После повторных введений средняя минимальная концентрация свободного фарицимаба в плазме крови прогнозируется на уровне 0,002–0,003 мкг/мл при введении каждые 8 нед.
Фарицимаб показал пропорциональную дозе фармакокинетику (на основе Cmax и AUC) в диапазоне доз 0,5–6 мг. Не отмечалось кумуляции фарицимаба в стеклянном теле или в плазме крови после ежемесячного введения, учитывая показатели экспозиции, полученные в популяционной фармакокинетической модели.
Распределение
Нет данных.
Метаболизм
Метаболизм фарицимаба напрямую не изучался. Предполагается, что фарицимаб катаболизируется на небольшие пептиды и аминокислоты в лизосомах подобно эндогенным молекулам IgG.
Вывод
Профиль концентрация-время фарицимаба в плазме крови снижался параллельно с профилем концентрация-время в стеклянном теле и внутриглазной жидкости. Расчетный средний период полувыведения из глаза и системный период полувыведения фарицимаба составляют по 7,5 дня.
Особые группы пациентов
Нарушение функции печени
Формальное исследование фармакокинетики у пациентов с нарушением функции печени не проводилось.
Нарушение функции почек
Формальное исследование фармакокинетики у пациентов с нарушением функции почек не проводилось.
Фармакокинетический анализ данных пациентов во всех клинических исследованиях, включая 857 пациентов с легким, 532 пациента с умеренным и 37 пациентов с тяжелым нарушением функции почек, не выявил отличия в системной фармакокинетике фарицимаба после интравитреального введения препарата Вабисмо.
Пациенты пожилого возраста
В четырех клинических исследованиях III фазы примерно 60% (1149/1929) пациентов, рандомизированных для лечения препаратом Вабисмо, были в возрасте ≥ 65 лет. Популяционный фармакокинетический анализ показал влияние возраста на фармакокинетику фарицимаба в органах зрения, однако он был расценен как клинически незначимый.
Другие демографические факторы
Популяционный фармакокинетический анализ показал влияние массы тела на фармакокинетику фарицимаба в глазу, а также системную фармакокинетику фарицимаба. Этот эффект был расценен как клинически незначимый; ввиду этого коррекция дозы не требуется.
Популяционно-кинетический анализ свидетельствует об отсутствии какого-либо влияния этнического происхождения или пола пациента на системную фармакокинетику препарата Вабисмо.
Показания
Лечение диабетического макулярного отека (ДМН).
Противопоказания
Активное внутриглазное воспаление.
Установлена гиперчувствительность к фарицимабу или любому вспомогательному веществу лекарственного средства. Реакции гиперчувствительности могут проявляться сыпью, зудом, крапивницей, эритемой или тяжелым внутриглазным воспалением.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Особенности применения
Интравитреальные инъекции, в том числе препарата Вабисмо, ассоциировались с эндофтальмитом, внутриглазным воспалением, регматогенным отслоением сетчатки, разрывом сетчатки и ятрогенной травматической катарактой. При введении препарата Вабисмо необходимо всегда соблюдать надлежащую асептическую технику инъекции. Пациентам следует проинструктировать о необходимости немедленно сообщать о любых симптомах, таких как боль, потеря зрения, фотофобия, нечеткость зрения, плавающее помутнение или покраснение, свидетельствующие об эндофтальмите или любом из указанных выше явлений, с целью обеспечения своевременного и надлежащего лечения .
Tранзиторное повышение внутриглазного давления (ВОТ) наблюдалось в течение 60 минут после интравитеральной инъекции, в том числе при введении препарата Вабисмо. Особые меры предосторожности необходимы для пациентов с плохо контролируемой глаукомой (не вводить препарат Вабисмо при ВГД ≥ 30 мм рт. ст.). Во всех случаях как ВГД, так и перфузию диска зрительного нерва и/или остроту зрения необходимо контролировать соответствующим образом и лечить при необходимости.
Системные эффекты
Сообщалось о системных нежелательных явлениях, в том числе об артериальных тромбоэмболиях. Существует теоретический риск, что эти явления могут быть связаны с подавлением фактора роста эндотелия сосудов (VEGF).
Иммуногенность
Действующее вещество Вабисмо является терапевтическим белком. Поэтому возможно возникновение иммунологической реакции на препарат Вабисмо. Пациентам следует проинструктировать о необходимости сообщать о каких-либо признаках или симптомах внутриглазного воспаления, таких как потеря зрения, боль в глазах, повышение чувствительности к свету, плавающие помутнения или усиление покраснения глаз, которые могут быть клиническими признаками, связанными с гиперчувствительностью.
Двухстороннее лечение
Безопасность и эффективность препарата Вабисмо при введении в оба глаза не изучались.
Сопутствующее применение других анти-VEGF лекарственных средств
Нет данных о сопутствующем применении препарата Вабисмо с анти-VEGF лекарственными средствами в один глаз.
Приостановка лечения
Лечение следует первоначально приостановить пациентам с:
- регматогенной отслойкой сетчатки, перфорацией сетчатки 3 или 4 степени тяжести, разрывом сетчатки; лечение не следует восстанавливать, пока не достигнуто заживление должного уровня;
- связанным с лечением снижением наилучшей скорректированной остроты зрения (BCVA) на ≥ 30 букв по сравнению с последней оценкой остроты зрения; лечение не следует восстанавливать раньше следующего запланированного введения препарата;
- выполненным или запланированным внутриглазным хирургическим вмешательством в течение предыдущих или последующих 28 дней; лечение не следует восстанавливать раньше следующего запланированного введения препарата.
Факторы риска, ассоциируемые с возникновением разрыва пигментного эпителия сетчатки после анти-VEGF терапии по поводу нВМД, включают распространенную и/или высокую отслойку пигментного эпителия. Поэтому при применении пациентам с этими факторами риска возникновения разрыва пигментного эпителия сетчатки следует соблюдать осторожность в начале терапии препаратом Вабисмо.
Популяции с ограниченными данными
Существует лишь ограниченный опыт лечения пациентов с ДМН с уровнем HbA1c более 10%, пациентов с пролиферативной диабетической ретинопатией с высоким риском или пациентов с нВМД и ДМН с активными системными инфекциями. Также нет опыта лечения препаратом Вабисмо больных сахарным диабетом с неконтролируемой артериальной гипертензией. Врачу необходимо учитывать отсутствие этой информации при лечении таких пациентов.
Злоупотребление лекарственными средствами и зависимость
Нет данных о возможности развития злоупотребления и зависимости при применении препарата Вабисмо.
Другая информация
Препарат Вабисмо, раствор для инъекций для интравитреального применения, содержит менее 1 ммоль (23 мг)/дозу натрия, т.е. практически свободен от натрия.
Способность влиять на скорость реакции при управлении автотранспортом или работе с механизмами
Применение в период беременности или кормления грудью
Женщинам репродуктивного возраста необходимо использовать эффективную контрацепцию при лечении препаратом Вабисмо и в течение не менее 3 месяцев после введения последней дозы препарата Вабисмо.
Беременность
Нет данных о применении препарата Вабисмо беременным женщинам.
Не наблюдалось побочных эффектов в исследовании на беременных яванских макаках.
Было показано, что угнетение VEGF влечет за собой пороки развития, резорбцию эмбриона/плода и снижение массы тела плода. учитывая доклинические данные угнетения Аng-2 может привести к эффектам, сопоставимым с таковыми при подавлении VEGF. Системная экспозиция после введения препарата Вабисмо в орган зрения очень низкая.
Неизвестно, проникает ли фарицим через плаценту или наносит вред плоду при применении беременным женщинам. , фарицимаб не следует применять во время беременности, за исключением случаев, когда потребность в лечении обусловлена клиническим состоянием женщины.
Роды
Безопасность применения препарата Вабисмо во время родов не установлена.
Кормление грудью
Неизвестно, экскретируется ли препарат Вабисмо в грудное молоко человека. Не проводились исследования влияния Вабисмо на продуцирование молока или наличия препарата в грудном молоке. При применении препарата Вабисмо женщинам, кормящим грудью. развития и здоровья ребенка с клинической потребностью в лечении матери препаратом Вабисмо и любым потенциальным нежелательным влиянием препарата Вабисмо на ребенка, получающего грудное молоко.
Фертильность
Исследования влияния на репродуктивную функцию или фертильность не проводились. AUC) Было показано, что угнетение VEGF не влияет. на развитие фолликулов, функцию желтого тела и фертильность Ввиду механизма действия ингибиторов VEGF и Ang-2 существует потенциальный риск для репродуктивного потенциала женщин и эмбриофетального развития, однако этот риск считается низким из-за низкой системной экспозиции после введения препарата в орган зрения.
Способ применения и дозы
Только для интравитреальной инъекции. Препарат Вабисмо должен вводить квалифицированный врач, имеющий опыт выполнения интравитреальных инъекций. Препарат из одного флакона следует использовать только для лечения одного глаза.
Однодозовый стеклянный флакон с препаратом Вабисмо содержит 28,8 мг фарицимаба в 0,24 мл раствора. Это обеспечивает необходимое количество раствора для инъекции 0,05 мл, содержащего 6 мг фарицимаба в качестве однократной дозы.
Неоваскулярная (экссудативная) возрастная макулярная дегенерация (нВМД)
Рекомендованная доза препарата Вабисмо составляет 6 мг (0,05 мл) путем интравитреальной инъекции каждые 4 недели (примерно каждые 28 ± 7 дней или один раз в месяц) для первых 4 введений. В дальнейшем график лечения можно индивидуализировать с продлением интервалов между введениями препарата. На основании оценки врачом толщины центральной части сетчатки пациента (толщина центрального подполя, CST) и/или показателя остроты зрения интервал между введениями можно продлить максимум до каждые 16 недель (4 месяца). Интервал между введениями необходимо соответственно снизить при ухудшении показателя CST и/или показателя остроты зрения (см. раздел «Фармакодинамика»).
Некоторые пациенты могут потребовать введения с частотой каждые 4 недели (примерно каждые 28±7 дней или один раз в месяц).
Мониторинг между визитами препарата следует планировать в зависимости от состояния пациента и по усмотрению врача.
Диабетический макулярный отек (ДМН)
Рекомендуемая доза препарата Вабисмо составляет 6 мг (0,05 мл) путем интравитреальной инъекции каждые 4 недели (примерно каждые 28 ± 7 дней или один раз в месяц) для первых 4 введений. В последствии график лечения можно индивидуализировать с помощью режима лечения с удлинением интервалов между введениями препарата. На основе оценки врача CST и/или остроты зрения отдельного пациента интервал между введениями можно продлить максимум до каждые 16 недель (4 месяца). Интервал между введениями необходимо соответствующим образом снизить при ухудшении CST и/или остроты зрения (см. раздел «Фармакодинамика»).
Мониторинг между визитами препарата следует планировать в зависимости от состояния пациента и по усмотрению врача, однако нет требования ежемесячного мониторинга между инъекциями.
В целях обеспечения отслеживания биологических лекарственных средств рекомендуется документировать торговое название и номер серии при каждом введении лекарственного средства.
Продолжительность лечения
Препарат Вабисмо предназначен для длительного лечения.
Коррекция дозы после возникновения нежелательных эффектов/взаимодействий
Изменение дозы препарата Вабисмо не рекомендуется.
Отложенное введение
Если инъекция отложена или пропущена, пациенту необходимо вернуться на обследование врача во время следующего доступного визита и продолжать введение препарата в зависимости от решения врача.
Если результаты визуального и/или анатомического обследования свидетельствуют о том, что пациент не пользуется продолжением лечения, лечение препаратом Вабисмо следует прекратить.
Особые группы пациентов
Нарушение функции печени
Специальные исследования препарата Вабисмо с участием пациентов с нарушением функции печени не проводились (см. раздел «Фармакокинетика»).
Однако коррекция дозы не требуется пациентам с нарушением функции печени.
Нарушение функции почек
Специальные исследования препарата Вабисмо с участием пациентов с нарушением функции почек не проводились (см. раздел «Фармакокинетика»).
Однако коррекция дозы не требуется пациентам с заболеваниями почек.
Пациенты пожилого возраста
В четырех исследованиях III фазы примерно 60% (1149/1929) пациентов, рандомизированных для получения лечения препаратом Вабисмо, были в возрасте ≥ 65 лет. Популяционный фармакокинетический анализ показал влияние возраста на фармакокинетику фарицимаба в органах зрения. Однако эффект был оценен как клинически не значимый. В этих исследованиях не выявлено существенного различия в эффективности или безопасности применения фарицимаба с увеличением возраста пациента. Коррекция дозы пациентам в возрасте ≥ 65 лет не требуется (см. раздел Фармакокинетика).
Дети
Безопасность и эффективность применения Вабисмо детям не установлены.
Особые группы пациентов
Специальная коррекция дозы не требуется для какой-либо из исследуемых популяций пациентов (в частности, по возрасту (пожилые пациенты), по полу и расе).
Инструкции по применению
Перед введением препарат Вабисмо необходимо осмотреть визуально о наличии посторонних частиц и изменении окраски.
Непосредственно после интравитреальной инъекции за состоянием пациентов необходимо наблюдать повышение внутриглазного давления. Надлежащий мониторинг может включать проверку перфузии диска зрительного нерва или тонометрии. Стерильное оборудование для парацентеза должно быть доступно при необходимости.
После интравитреальной инъекции пациентов следует проинструктировать о необходимости немедленно сообщать о любых симптомах, свидетельствующих об эндофтальмите (например, потеря зрения, боль в глазах, покраснение глаз, фотофобия, нечеткость зрения).
Приготовление препарата к введению
Препарат Вабисмо является стерильным прозрачным или опалесцирующим раствором, не содержащим консервантов, бесцветным или коричневато-желтого цвета.
Препарат Вабисмо необходимо осмотреть визуально после извлечения из холодильника и перед вводом.
При наличии посторонних частиц, помутнения или изменения окраски флакон использовать нельзя.
Содержимое флакона и игла с фильтром для переноски являются стерильными и предназначены только для однократного использования. Не применять препарат, если упаковка, флакон и/или игла с фильтром для переноски повреждены или их срок годности истек.
При приготовлении к интравитреальной инъекции необходимо соблюдать правила асептики.
Инструкции по применению препарата
Нижеприведенная информация предназначена только для медицинских работников.
Перед началом:
- Внимательно прочесть все инструкции перед применением препарата Вабисмо.
- Упаковка препарата Вабисмо включает стеклянный флакон с лекарственным средством и иглу с фильтром для переноски. Стеклянный флакон содержит только однократную дозу. Игла с фильтром предназначена только для однократного использования.
- Препарат Вабисмо следует хранить в холодильнике при температуре от 2 до 8°C. Не замораживать. Не стряхивать.
- Перед введением дать возможность препарату Вабисмо достичь комнатной температуры (от 20 до 25 °C). Хранить флакон в оригинальной картонной упаковке для защиты от света.
- Флакон препарата Вабисмо можно хранить при комнатной температуре в течение 24 часов.
- Перед введением флакона с препаратом Вабисмо необходимо осмотреть визуально. Препарат Вабисмо является прозрачным или опалесцирующим раствором, бесцветным или коричневато-желтого цвета.
Не использовать препарат, если упаковка, флакон и/или игла с фильтром для переноски открыты, повреждены или срок годности истек (см. рисунок A).
- При приготовлении к интравитреальной инъекции необходимо соблюдать правила асептики.
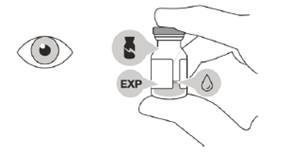
Рисунок А
Инструкции по использованию флакона:
1. Собрать следующие средства:
- Один флакон препарата Вабисмо (в картонной коробке).
- Одна стерильная игла с фильтром для переноски с тупым концом, 5 микрон, размером 18G×11/2дюйма или примерно 1,2 мм×40 мм (в картонной коробке).
- Один стерильный шприц Luer lock объемом 1 мл со значком дозы 0,05 мл (не добавляется).
- Одна стерильная игла для инъекций размером 30G × 1/2 дюйма (не добавляется).
- Следует отметить, что игла для инъекций 30G рекомендуется во избежание увеличения силы введения, что может быть необходимым при использовании игл меньшего диаметра.
- Спиртовой тампон (не прилагается).
 |
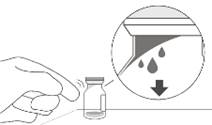 |
Рисунок В |
Рисунок С |
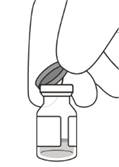
3. Снять с флакона колпачок (см. рисунок D) и протереть перегородку флакона спиртовым тампоном (см. рисунок E).
 |
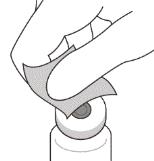 |
Рисунок D |
Рисунок Е |
4. Соблюдая правила асептики, прочно прикрепить добавленную иглу с фильтром для переноски 18G × 11/2дюйма к шприцу Luer Lock объемом 1 мл (см. рисунок F).
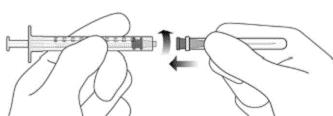
Рисунок F
5. Следуя правилам асептики, ввести иглу с фильтром для переноски в центр перегородки флакона (см. рисунок G), вжать ее до конца во флакон, затем слегка наклонить флакон так, чтобы игла коснулась нижнего края флакона (см. рисунок H).
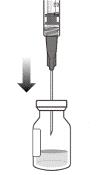 |
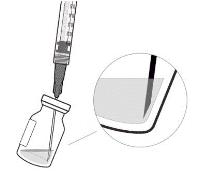 |
Рисунок G |
Рисунок Н |
6. Держать флакон слегка наклоненным и медленно вытащить всю жидкость из флакона (см. рисунок I). Держите конец иглы с фильтром для переноски погруженным в жидкость во избежание попадания воздуха.
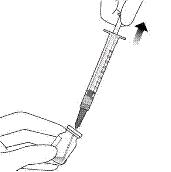
Рисунок I
7. Убедитесь, что шток поршня достаточно оттянут назад во время опорожнения флакона, чтобы полностью опорожнить иглу с переносным фильтром (см. рисунок I).
8. Отсоединить иглу с фильтром для переноски от шприца и утилизировать ее в соответствии с местными требованиями.
Не использовать иглу с фильтром для переноса интравитреальной инъекции.
9. Следуя правилам асептики, крепко прикрепить иглу для инъекций 30G × 11/2 дюйма к шприцу Luer Lock (см. рисунок J).
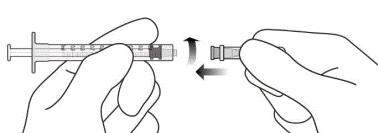
Рисунок J
10. Аккуратно снять пластиковый колпачок иглы с иглы, потянув его.
11. Чтобы проверить наличие пузырьков воздуха, держать шприц иглой вверх.
12. Аккуратно удалить воздух из шприца и иглы и медленно нажать на поршень, чтобы совместить край резинового уплотнителя поршня с отметкой дозы 0,05 мл. Теперь шприц готов к инъекции (см. рисунок L). немедленно после приготовления дозы.
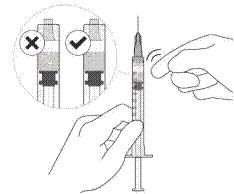 |
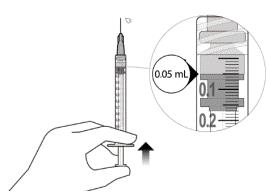 |
Рисунок К |
Рисунок L |
13. Медленно вводить, пока резиновый уплотнитель поршня не достигнет передней части шприца, чтобы ввести объем 0,05 мл. Подтвердите введение полной дозы, проверив, что резиновый уплотнитель достиг передней части шприца после инъекции.
Любое неиспользованное лекарственное средство или отходы необходимо утилизировать в соответствии с местными требованиями.
Дети
Передозировка
При передозировке необходимо контролировать ВГД и, если врач считает целесообразным, необходимо начать соответствующее лечение.
Побочные реакции
Резюме профиля безопасности по результатам клинических исследований
Следующие данные по безопасности были получены в исследованиях III фазы с активным контролем (афлиберцепт).
В общей сложности 3213 пациентов вошли в популяцию для оценки безопасности в четырех клинических исследованиях III фазы продолжительностью два года (1926 пациентов, получавших лечение препаратом Вабисмо: 664 пациента с нВМД и 1262 пациента с ДМН). Наиболее серьезными побочными реакциями были катаракта (1,0 %), увеит (0,6 %), эндофтальмит (0,5 %), витрита (0,3 %), разрывы сетчатки (0,2 %), регматогенная отслойка сетчатки ( 0,1%) и травматическая катаракта (<0,1%).
Наиболее частыми побочными реакциями, зарегистрированными у пациентов, получавших лечение препаратом Вабисмо, были катаракта (13%), конъюнктивальное кровоизлияние (8%), отслойка сетчатки (5%), повышение ВГД (4%), плавающие помутнения стеклянного тела. 4%), боль в глазах (3%) и разрыв пигментного эпителия сетчатки (только у пациентов с нВМД) (3%).
Описанные ниже данные по безопасности включают перечень всех побочных реакций, наблюдавшихся в четырех клинических исследованиях III фазы, проведенных с участием пациентов с нВМД и ДМН, а также данные послерегистрационного наблюдения с обоснованием возможности причинно-следственной связи с проведением инъекции или с лекарственным средством. Побочные реакции приведены в соответствии с классом системы органов по MedDRA и следующим категориям частоты: очень часто (≥ 1/10), часто (≥ 1/100–< 1/10), нечасто (≥ 1/1 000–< 1/100) , редко (≥ 1/10 000–< 1/1000), частота неизвестна (частота не может быть рассчитана на основании имеющихся данных).
Tаблица 7. Резюме побочных реакций
|
Побочные реакции |
Вабисмо, N = 1 926 |
Категория частоты |
|
Со стороны органов зрения |
||
|
Катаракта |
12,7 % |
Очень часто |
|
Конъюнктивальное кровоизлияние |
8,0 % |
Часто |
|
Отслойка сетчатки |
4,8 % |
Часто |
|
Повышение внутриглазного давления |
4,2 % |
Часто |
|
Плавающие помутнения стеклянного тела |
4,1 % |
Часто |
|
Разрыв пигментного эпителия сетчатки (лишь нВМД) |
2,9 % |
Часто |
|
Боль в глазах |
3,0 % |
Часто |
|
Увеличение слезотечения |
1,1 % |
Часто |
|
Эрозия роговицы |
1,1 % |
Часто |
|
Раздражение глаз |
1,0 % |
Часто |
|
Дискомфорт в глазах |
0,9 % |
Нечасто |
|
Зуд в глазах |
0,9 % |
Нечасто |
|
Гиперемия глаз |
0,8 % |
Нечасто |
|
Нечеткость зрения |
0,8 % |
Нечасто |
|
Снижение остроты зрения |
0,7 % |
Нечасто |
|
Ирит |
0,7 % |
Нечасто |
|
Увеит |
0,6 % |
Нечасто |
|
Эндофтальмит |
0,5 % |
Нечасто |
|
Чувство постороннего тела |
0,5 % |
Нечасто |
|
Кровоизлияние в стекловатое тело |
0,5 % |
Нечасто |
|
Иридоциклит |
0,4 % |
Нечасто |
|
Витрит |
0,3 % |
Нечасто |
|
Гиперемия конъюнктивы |
0,3 % |
Нечасто |
|
Боль во время проведения процедуры |
0,2 % |
Нечасто |
|
Разрыв сетчатки |
0,2 % |
Нечасто |
|
Регматогенная отслойка сетчатки |
0,1 % |
Нечасто |
|
Транзиторное снижение остроты зрения |
< 0,1 % |
Редко |
|
Травматическая катаракта |
< 0,1 % |
Редко |
|
Васкулит сетчатки* |
- |
Частота неизвестна |
|
Окклюзионный васкулит сетчатки* |
- |
Частота неизвестна |
* Побочные реакции, которые были обнаружены на основе спонтанных постмаркетинговых сообщений. Поскольку эти реакции сообщения поступали добровольно от популяции неопределенной численности, невозможно достоверно оценить их частоту.
Описание отдельных побочных реакций и дополнительная информация
После интравитреального введения ингибиторов VEGF существует теоретический риск артериальной тромбоэмболии, включая инсульт и инфаркт миокарда. Низкая частота артериальной тромбоэмболии наблюдалась в клинических исследованиях препарата Вабисмо у пациентов с нВМД и ДМН. Не наблюдалось заметного различия между группами, получавшими лечение препаратом Вабисмо и препаратом сравнения, при разных показаниях.
Срок годности
Условия хранения
Не замораживать. Не стряхивать. Хранить в недоступном для детей месте.
Перед использованием неоткрытый флакон препарата Вабисмо можно хранить при комнатной температуре (от 20°C до 25°C) в течение 24 часов.
Необходимо обеспечить немедленное выполнение инъекции после приготовления дозы.
Несовместимость
При отсутствии исследований несовместимости это лекарственное средство не следует смешивать с другими лекарственными средствами.
Упаковка
Флакон объемом 2 мл из бесцветного боросиликатного стекла класса I, укупоренный резиновой пробкой серого цвета из бутилкаучука диаметром 13 мм, ламинированной фторкаучуком и обжатый алюминиевым колпачком диаметром 13 мм с пластиковым диском типа «flip-off».
Игла с фильтром
Игла из нержавеющей стали 18 G с фильтром 5 мкм из акрилового сополимера с полипропиленовым колпачком.
По 1 флакону в комплекте с иглой с фильтром, упакованной в блистер в картонной коробке.
Категория отпуска
Производитель
Местонахождение производителя и его адрес места осуществления деятельности
Источник инструкции
Обратите внимание!
Инструкция, размещенная на данной странице, носит информационный характер и предназначена исключительно для ознакомительных целей. Не используйте данную инструкцию в качестве медицинских рекомендаций.
Постановка диагноза и выбор методики лечения осуществляется только вашим лечащим врачом!
podorozhnyk.ua не несет ответственности за возможные негативные последствия, возникшие в результате использования информации, размещенной на сайте podorozhnyk.ua. Подробнее об отказе от ответственности.