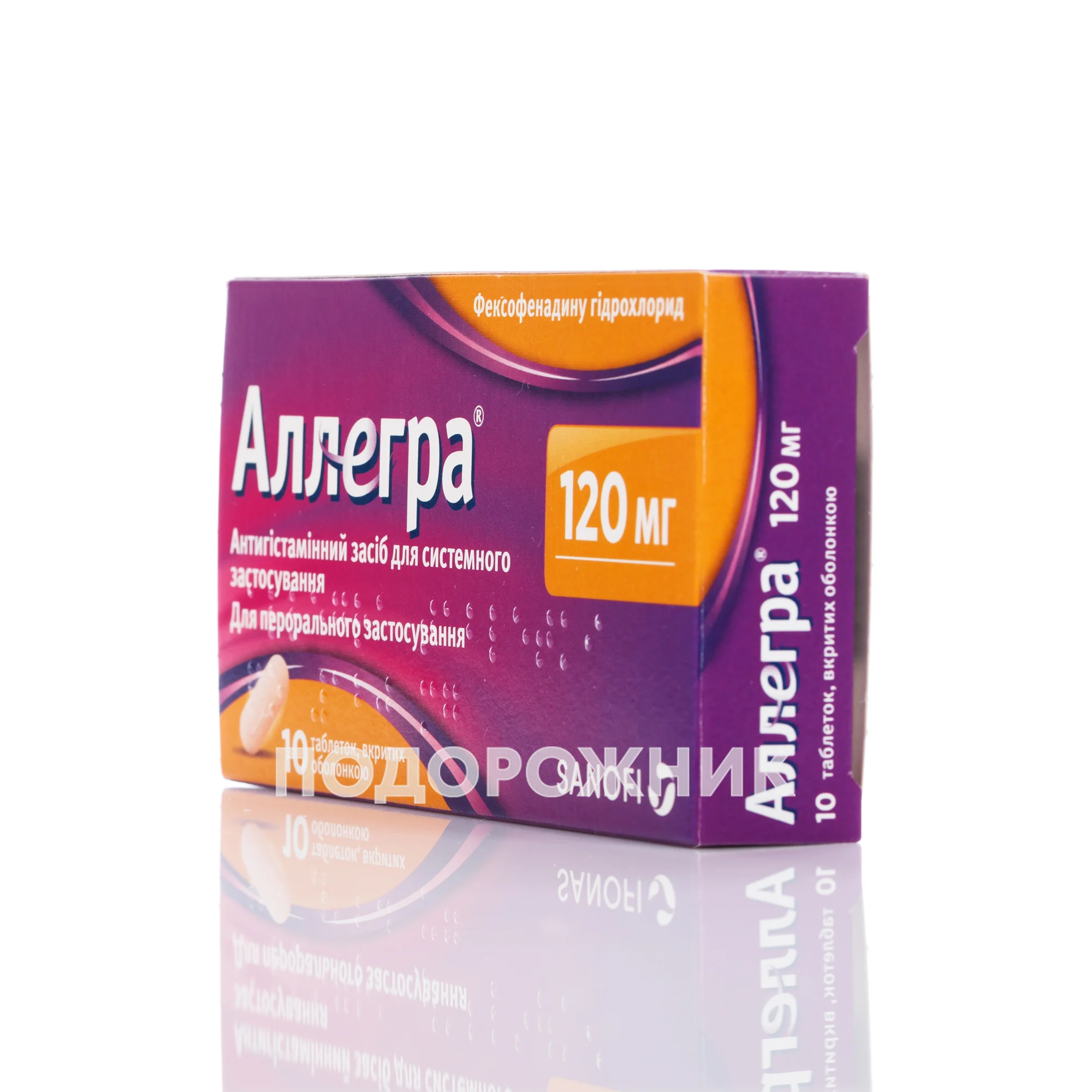











Аллегра таблетки по 120 мг, 10 шт.
Отримайте AI аналітику щодо товару Аллегра таблетки по 120 мг, 10 шт.:
Алергікам | |
Діабетикам | |
Водіям | |
Вагітним | |
Годуючим матерям | |
Дітям | |
Рецептурний відпуск | |
Температура зберігання |
Властивості препарату Аллегра таблетки по 120 мг, 10 шт.
Основні
| Діюча речовина | |
| Торгівельна назва | |
| Категорія | |
| GTIN | 3582910072164 |
| Країна виробник | Франція |
| Кількість в упаковці | 10 |
| Код АТС/ATX | |
| Рецептурний відпуск | без рецепта |
| Код Моріон | 317373 |
| Первинна упаковка | Блістер |
| Міжнародне найменування | Fexofenadine |
| Температура зберігання | від 5 °С до 25 °С |
| Термін придатності | 3 роки |
| Упаковка | По 10 таблеток у блістері, по 1 блістеру в упаковці |
| Форма випуску | Таблетки |
| Дозування | 120 мг |
| Спосіб введення | орально |
| Виробник |
Кому можна
| Алергікам | з обережністю |
| Діабетикам | з обережністю |
| Водіям | дозволено |
| Вагітним | заборонено |
| Годуючим матерям | заборонено |
| Дітям | з 12 років |
Аллегра таблетки по 120 мг, 10 шт. - Інструкція для застосування
Склад
діюча речовина: фексофенадину гідрохлорид;
1 таблетка містить фексофенадину гідрохлориду 120 мг (еквівалентно 112 мг фексофенадину);
допоміжні речовини: целюлоза мікрокристалічна, крохмаль прежелатинізований, натрію кроскармелоза, магнію стеарат, гіпромелоза, повідон, титану діоксид (Е 171), кремнію діоксид колоїдний безводний, макрогол 400, суміш заліза оксиду жовта (Е 172) та суміш заліза оксиду рожева (Е 172).
Лікарська форма
Таблетки, вкриті оболонкою.
Основні фізико-хімічні властивості: таблетки персикового кольору у формі капсули, вкриті оболонкою, з тисненням «012» з одного боку та тисненням у вигляді прописної літери «е» з іншого боку.
Фармакотерапевтична група
Антигістамінні засоби для системного застосування. Код АТХ R06A Х26.
Фармакодинаміка
Фексофенадину гідрохлорид – неседативний антигістамінний засіб групи антагоністів специфічних рецепторів Н1. Фексофенадин є фармакологічно активним метаболітом терфенадину.
У клінічних дослідженнях пухирів та гіперемії шкіри, індукованих гістаміном, антигістамінний ефект фексофенадину гідрохлориду, який призначали 1 та 2 рази на добу, проявився протягом 1 години, досягнувши максимуму через 6 годин і тривав протягом 24 годин. Ознак розвитку непереносимості не було виявлено навіть після 28-денного прийому. Клінічний ефект спостерігався після одноразових пероральних доз від 10 до 130 мг. У цій моделі антигістамінної ефективності для забезпечення постійного ефекту протягом 24 годин були необхідні дози не менше 130 мг. Максимум пригнічення набряклості та гіперемії перевищував 80 %. Клінічні дослідження сезонного алергічного риніту показують, що доза 120 мг достатня для забезпечення 24-годинної ефективності.
У хворих із сезонним алергічним ринітом, які приймали дозу до 240 мг фексофенадину гідрохлориду 2 рази на добу протягом 2 тижнів, статистично значущих змін QT−інтервалу порівняно з плацебо не спостерігалося.
Також порівняно з плацебо не спостерігалося подібних змін і у здорових добровольців, які приймали до 60 мг фексофенадину гідрохлориду 2 рази на добу протягом 6 місяців, по 400 мг фексофенадину гідрохлориду 2 рази на добу протягом 6,5 дня та по 240 мг на добу протягом року. У дітей віком від 6 до 11 років не спостерігалося статистично значущих змін інтервалу QT порівняно з плацебо після застосування фексофенадину гідрохлориду у дозі 60 мг 2 рази на добу протягом 2 тижнів.
Навіть при концентраціях у плазмі крові, що в 32 рази перевищували терапевтичні концентрації, фексофенадин у людей не виявляв впливу на калієві канали сповільненого випрямлення, клоновані з міокарду людини.
Фармакокінетика
Фексофенадину гідрохлорид швидко всмоктується після застосування внутрішньо. Максимальна концентрація досягається приблизно через 1−3 години. Максимальна концентрація становить приблизно 289 нг/мл після однократного прийому препарату у дозі 120 мг 1 раз на добу та приблизно 494 нг/мл після однократного прийому препарату у дозі 180 мг 1 раз на добу.
60−70 % фексофенадину зв’язується з білками плазми крові.
Фексофенадин не метаболізується у печінці. Він метаболізується дуже незначною мірою, оскільки в сечі та калі виявляється основна речовина препарату. Виведення фексофенадину з плазми крові відбувається з двофазним зниженням та термінальним періодом напіввиведення від 11 до 15 годин після багаторазового застосування. Кінетика одноразової та багаторазової доз лінійна при пероральних дозах до 120 мг 2 рази на добу.
Згідно з даними досліджень, що були проведені на цей час, більша частина дози виводиться з жовчю, з сечею у незміненій формі виводиться до 10 %.
Показання
Симптоматичне лікування сезонного алергічного риніту у дорослих та дітей віком від 12 років.
Протипоказання
Підвищена чутливість до фексофенадину гідрохлориду або до інших компонентів препарату.
Дитячий вік до 12 років з огляду на відсутність належних даних з безпеки та ефективності.
Взаємодія з іншими лікарськими засобами та інші види взаємодій
Фексофенадин не метаболізується у печінці і тому не взаємодіє з іншими лікарськими засобами цим шляхом.
Комбінації, які вимагають запобіжних заходів при застосуванні
При одночасному призначенні з еритроміцином або кетоконазолом спостерігалося 2−3-разове збільшення концентрації фексофенадину у плазмі крові. Вплив на QT−інтервал не був пов’язаний з цією зміною; частота побічних реакцій не збільшувалася порівняно з такою при прийомі кожної з цих речовин окремо. Дослідження на експериментальних тваринах показали, що підвищення концентрації фексофенадину у плазмі крові, яке спостерігалося після одночасного застосування еритроміцину або кетоконазолу, може бути обумовлене збільшенням всмоктування препарату у шлунково-кишковому тракті та зменшенням або екскреції препарату у жовчних шляхах, або його секреції у шлунково-кишковому тракті.
Взаємодія з омепразолом не спостерігалася.
Шлунково-кишкові засоби місцевої дії, антациди і адсорбенти. Застосування антацидів, що містять гідроксиди алюмінію або магнію, за 15 хвилин до прийому препарату Аллегра 120 мг знижує біодоступність фексофенадину гідрохлориду, ймовірно через його зв’язування у шлунково-кишковому тракті, тим самим зменшуючи всмоктування фексофенадину у шлунково-кишковому тракті. Слід дотримуватись інтервалу (за можливості тривалістю більше 2 годин) між застосуванням фексофенадину гідрохлориду та шлунково-кишкових засобів місцевої дії.
Особливості застосування
Слід дотримуватись обережності при застосуванні препарату Аллегра 120 мг хворим літнього віку та пацієнтам із порушенням печінкової або ниркової функції через недостатність даних.
Пацієнтам, які перенесли у минулому або мають тепер серцево-судинні захворювання, слід мати на увазі, що препарати класу антигістамінів можуть сприяти виникненню таких побічних ефектів, як тахікардія та відчуття серцебиття (див. розділ «Побічні ефекти»).
Здатність впливати на швидкість реакції при керуванні автотранспортом або іншими механізмами
На підставі фармакодинамічного профілю та наявних на сьогодні даних про побічні ефекти негативного впливу фексофенадину гідрохлориду на здатність керувати автомобілем або працювати з іншими механізмами не виявлено. Під час проведення випробувань істотного впливу препарату Аллегра 120 мг на функцію центральної нервової системи не виявлено. Пацієнтам можна керувати автомобілем або виконувати роботу, що потребує концентрації уваги.
Однак при наявності підвищеної чутливості до препарату рекомендується попередньо перевірити індивідуальну реакцію хворого на лікарський засіб.
Застосування у період вагітності або годування груддю
Вагітність. Дані про застосування вагітним жінкам недостатні. Нечисленні дослідження на тваринах не вказують на наявність прямого або опосередкованого впливу на вагітність, ембріональний/фетальний розвиток, пологи або постнатальний розвиток. Фексофенадину гідрохлорид не можна застосовувати у період вагітності, окрім випадків нагальної потреби, коли очікувана користь для матері переважає можливий ризик для плода.
Годування груддю. Оскільки фексофенадин проникає у грудне молоко, препарат Аллегра 120 мг не можна застосовувати у період годування груддю.
Спосіб застосування та дози
Рекомендована доза фексофенадину гідрохлориду для дорослих та дітей віком від 12 років становить 120 мг на добу за один прийом, тобто одна таблетка 120 мг 1 раз на добу.
Спосіб застосування: пероральний прийом.
Діти
Препарат не застосовувати дітям віком до 12 років.
Передозування
Повідомлялося про виникнення запаморочення, сонливості, підвищеної втомлюваності та сухості у роті внаслідок передозування фексофенадину гідрохлориду. Порівняно з плацебо дози до 60 мг двічі на добу протягом 2 тижнів у дітей, а також одноразові дози до 800 мг та дози по 690 мг 2 рази на добу протягом 1 місяця, а також по 240 мг 1 раз на добу протягом 1 року у здорових добровольців не спричиняли будь-яких істотних з клінічної точки зору побічних ефектів. Максимальна переносима доза фексофенадину гідрохлориду наразі не встановлена.
У разі значного передозування слід застосовувати симптоматичне лікування та контролювати життєво важливі функції. Видалення фексофенадину гідрохлориду з крові за допомогою гемодіалізу неефективне. Наразі невідомо про існування антидоту до препарату.
Побічні реакції
Побічні реакції, що спостерігалися у дорослих осіб під час контрольованих клінічних досліджень, розподілені за системами органів та частотою виникнення: дуже часті (> 1/10), часті (> 1/100, <1/10), нечасті (> 1/1000, <1/100), рідкісні (> 1/10000, <1/1000), дуже рідкісні (<1/10000), частота невідома.
З боку нервової системи. Часто: головний біль, сонливість, запаморочення.
З боку шлунково-кишкового тракту. Часто: нудота. Частота невідома: сухість у роті.
Загальні розлади та реакції у місці введення. Нечасто: підвищена втомлюваність.
Під час постмаркетингового спостереження повідомлялося про нижчезазанчені небажані ефекти у дорослих (частота виникнення цих ефектів невідома і не може бути оцінена на основі наявних даних)
З боку імунної системи. Реакції гіперчутливості, що проявлялися у вигляді ангіоневротичного набряку, відчуття стиснення у грудях, задишки, відчуття припливів та інших системних анафілактичних реакцій.
З боку психіки. Безсоння, нервозність, розлади сну або нічні кошмари/ незвичні сновидіння (хворобливі сновидіння).
З боку серця. Тахікардія, відчуття серцебиття.
З боку шлунково-кишкового тракту. Діарея.
З боку шкіри та підшкірної клітковини. Висипання, кропив’янка, свербіж.
Повідомлення про підозрювані побічні реакції. Повідомлення про підозрювані побічні реакції після затвердження лікарського засобу є важливою процедурою. Це дає змогу продовжувати моніторинг співвідношення користь/ризик для даного лікарського засобу. Медичні працівники мають повідомляти про усі підозрювані небажані реакції через національну систему повідомлень.
Термін придатності
3 роки.
Умови зберігання
Зберігати при температурі не вище 25 °С. Зберігати в недоступному для дітей місці.
Упаковка
По 10 таблеток у блістері; по 1 блістеру у картонній коробці.
Категорія відпуску
Без рецепта.
Виробник
САНОФІ ВІНТРОП ІНДАСТРІА - ТУРЗ, Франція/SANOFI WINTHROP INDUSTRIE - TOURS, France.
Місцезнаходження виробника та його адреса місця провадження діяльності
30-36 авеню Гюстав Ейфель, ТУРЗ, 37100, Франція/30-36 avenue Gustave Eiffel, TOURS, 37100, France.
Джерело інструкції
Зверніть увагу!
Опис лікарського засобу на цій сторінці носить виключно інформаційний характер. Для того, щоб вірно вибрати препарат для лікування вашого захворювання, звертайтесь до лікаря.
Самолікування може зашкодити вашому здоров'ю!
ᐉ Онлайн-аптека Подорожник • Замовлення ліків онлайн з доставкою • Мережа аптек по всій Україні не несе відповідальності за некоректне використання інформації, розміщеної на сайті, та можливі негативні наслідки цього. Детальніше про відмову від відповідальності.