- Основное
- Наличие в аптеках
- Инструкция
- Написать отзыв









Триксео аэросфера ингаляция под давлением по 5 мкг/7.2 мкг/160 мкг во флаконе 120 доз, 1 шт.
Получите AI аналитику по товару Триксео аэросфера ингаляция под давлением по 5 мкг/7.2 мкг/160 мкг во флаконе 120 доз, 1 шт.:
Аллергикам | |
Водителям | |
Беременным | |
Кормящим матерям | |
Детям | |
Температура хранения | |
Рецептурный отпуск |
Свойства препарата Триксео аэросфера ингаляция под давлением по 5 мкг/7.2 мкг/160 мкг во флаконе 120 доз, 1 шт.
Основные
| Торговое название | Триксео |
| Категория | |
| GTIN | 5000456075800 |
| Страна производитель | Франция |
| Импортный | Да |
| Температура хранения | от 5 °С до 25 °С |
| Срок годности | 2 года |
| Рецептурный отпуск | по рецепту |
| Упаковка | По 1 контейнеру в упаковке |
| Форма выпуска | Ингалятор |
| Кол-во в упаковке | 1 |
| Первичная упаковка | Флакон |
| Код Морион | 870081 |
| Способ введения | орально |
| Производитель |
Кому можна
| Аллергикам | с осторожностью |
| Водителям | разрешено |
| Беременным | с осторожностью |
| Кормящим матерям | с осторожностью |
| Детям | запрещено |
Перед публикацией Ваш отзыв может быть отредактирован для исправления грамматики, орфографии или удаления неприемлемых слов и контента. Отзывы, которые, как нам кажется, созданы заинтересованными сторонами, не будут опубликованы. Старайтесь рассказывать о собственном опыте, избегая обобщений.
Триксео аэросфера ингаляция под давлением по 5 мкг/7.2 мкг/160 мкг во флаконе 120 доз, 1 шт. - Инструкция по применению
Обратите внимание!
Это программа поддержки пациентов с острыми и хроническими заболеваниями в таких областях, как кардиология, эндокринология и пульмонология
Состав
1 ингаляция (доставленная доза) содержит 5 мкг формотерола фумарата дигидрата микронизированного в пересчете на 4,8 мкг безводного формотерола фумарата; 9 мкг гликопирония бромида микронизированного в пересчете на 7,2 мкг гликопирония и 160 мкг будесонида микронизированного;
это соответствует отмеренной дозе 5,3 мкг формотерола фумарата дигидрата микронизированного в пересчете на 5,1 мкг безводного формотерола фумарата; 9,6 мкг гликопирония бромида микронизированного в пересчете на 7,7 мкг гликопирония и 170 мкг будесонида микронизированного;
другие составляющие: 1,2-дистеароил-сн-глицеро-3-фосфохолин, кальция хлорида дигидрат, норфлуран (HFA-134a).
Лекарственная форма
Основные физико-химические свойства: суспензия белого цвета.
Фармакотерапевтическая группа
Фармакодинамика
Лікарський засіб Триксео Аеросфера містить будесонід, глюкокортикостероїд, і два бронхолітики — глікопіроній, антагоніст мускаринових рецепторів тривалої дії (антихолінергічний лікарський засіб), і формотерол, β2-агоніст тривалої дії.
Будесонід — це глюкокортикостероїд, який у разі інгаляційного застосування чинить швидку (протягом кількох годин) та дозозалежну протизапальну дію в дихальних шляхах.
Глікопіроній — це антагоніст мускаринових рецепторів тривалої дії, який часто називають антихолінергічним лікарським засобом. Основними мішенями для антихолінергічних лікарських засобів є мускаринові рецептори, що містяться в дихальних шляхах. В дихальних шляхах глікопіроній виявляє фармакологічні ефекти за рахунок пригнічення М3-холінорецепторів у гладких мя’зах, що призводить до бронходилатації. Антагонізм має конкурентний і оборотний характер. У дослідженні профілактика бронхоконстрикторних ефектів, спричинених метилхоліном і ацетилхоліном, була дозозалежною та тривала понад 12 годин.
Формотерол — це селективний агоніст β2-адренорецепторів, що в разі інгаляційного застосування призводить до швидкої та тривалої релаксації гладких м’язів бронхів у пацієнтів зі оборотною обструкцією дихальних шляхів. Бронхолітичний ефект залежить від дози; настання ефекту відбувається протягом 1–3 хвилин після інгаляції. Тривалість ефекту після застосування однієї дози становить не менше 12 годин.
Клінічна ефективність
Ефективність і безпеку застосування лікарського засобу Триксео Аеросфера оцінювали у пацієнтів з ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня в ETHOS і KRONOS, двох рандомізованих дослідженнях із паралельними групами. Обидва дослідження були багатоцентровими та подвійно сліпими. Пацієнти мали бал симптомів ≥ 10 відповідно до тесту щодо оцінювання ХОЗЛ (CAT) та щоденно застосовували два або більше підтримуючі лікарські засоби протягом принаймні 6 тижнів до скринінгу.
ETHOS являло собою 52-тижневе дослідження (N = 8588 рандомізованих учасників; 60 % становили чоловіки, середній вік 65 років), в якому порівнювали дві інгаляції двічі на добу лікарського засобу Триксео Аеросфера, ДАІ формотеролу фумарату дигідрату/глікопіронію (ФОРМ/ГЛІ) 5/7,2 мкг та ДАІ формотеролу фумарату дигідрату/будесоніду (ФОРМ/БУД) 5/160 мкг. Пацієнти мали ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня (ОФВ1 після застосування бронхолітика від ≥ 25 % до < 65 % від прогнозованого значення); вони повинні були мати в анамнезі одне або кілька загострень ХОЗЛ помірного або тяжкого ступеня протягом року, що передував скринінгу. Частка пацієнтів із помірним, тяжким або дуже тяжким ХОЗЛ становила 29 %, 61 % та 11 % відповідно. Середній вихідний ОФВ1 в усіх групах дорівнював 1,021–1,066 мл; на момент скринінгу середнє значення ОФВ1 після застосування бронхолітика становило 43 % від прогнозованого, а середній бал за тестом CAT дорівнював 19,6. Первинною кінцевою точкою дослідження ETHOS була частота загострень ХОЗЛ помірного або тяжкого ступеня на тлі застосування лікарського засобу Триксео Аеросфера у порівнянні із ДАІ ФОРМ/ГЛІ та ДАІ ФОРМ/БУД.
KRONOS — це 24-тижневе дослідження (N = 1902 рандомізовані учасники; 71 % становили чоловіки, середній вік 65 років), в якому порівнювали дві інгаляції двічі на день лікарського засобу Триксео Аеросфера, ДАІ ФОРМ/ГЛІ 5/7,2 мкг, ДАІ ФОРМ/БУД 5/160 мкг та у відкритому режимі порівняння з турбухалером формотеролу фумарату дигідрату/будесоніду (ТБХ ФОРМ/БУД) 6/200 мкг. У пацієнтів було ХОЗЛ помірного, тяжкого або дуже тяжкого ступеня (ОФВ1 після застосування бронхолітика від ≥ 25 % до < 80 % від прогнозованого значення). Частка пацієнтів із помірним, тяжким або дуже тяжким ХОЗЛ становила 49 %, 43 % та 8 %, відповідно. Середній вихідний ОФВ1 у всіх групах становив 1,050–1,193 мл, а на момент скринінгу середнє значення ОФВ1 після застосування бронхолітика становило 50 % від прогнозованого; понад 26 % пацієнтів повідомили про одне або кілька загострень ХОЗЛ помірного або тяжкого ступеня впродовж останнього року та середній бал оцінки симптомів за тестом CAT становив 18,3. У підгрупі учасників лікування було продовжено на 28 тижнів, тобто до 52 тижнів. Первинними кінцевими точками дослідження KRONOS були значення ОФВ1 від моменту часу 0 до 4 годин після застосування лікарського засобу (згідно площі під фармацевтичною кривою концентрація/час AUC0-4 ОФВ1) для групи застосування лікарського засобу Триксео Аеросфера у порівнянні із групою ДАІ ФОРМ/БУД та зміна ранкового мінімального ОФВ1, що вимірюється до застосування препарату, в порівнянні з вихідним значенням для групи застосування лікарського засобу Триксео Аеросфера у порівнянні із групою ДАІ ФОРМ/ГЛІ за 24 тижні.
На момент зарахування у дослідження найпоширенішими застосовуваними видами лікування проти ХОЗЛ, про які повідомлялося у дослідженнях ETHOS та KRONOS, були інгаляційний глюкокортикостероїд (ІГКС)+β2-агоніст тривалої дії (БАТД)+антагоніст мускаринових рецепторів тривалої дії (МХТД) (39 %, 27 % відповідно), ІГКС+БАТД (31 %, 38 % відповідно) та МХТД +БАТД (14 %, 20 % відповідно).
Вплив на загострення
Загострення помірного або тяжкого ступеня
У 52-тижневому дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще зниження річного показника загострень помірного/ тяжкого ступеня під час лікування на 24 % (95 % ДІ: 17, 31; p < 0,0001) у порівнянні з ДАІ ФОРМ/ГЛІ (частота; 1,08 проти 1,42 події на пацієнта на рік) та на 13 % (95 % ДІ: 5, 21; p = 0,0027) у порівнянні із ДАІ ФОРМ/БУД (частота; 1,08 проти 1,24 події на пацієнта на рік).
Спостережена користь за річним показником загострень ХОЗЛ помірного/ тяжкого ступеня протягом 24 тижнів у дослідженні KRONOS загалом відповідала такій, що була відзначена в дослідженні ETHOS. У групі лікарського засобу Триксео Аеросфера поліпшення у порівнянні із ДАІ ФОРМ/ГЛІ були статистично значущими, проте у порівнянні із ДАІ ФОРМ/БУД та ТБХ ФОРМ/БУД не досягли статистичної значущості.
Тяжкі загострення (що призвели до госпіталізації або смерті)
У дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано чисельне зниження річного показника тяжких загострень під час лікування на 16 % (95 % ДІ: -3,31; p = 0,0944) у порівнянні із ДАІ ФОРМ/ГЛІ (частота; 0,13 проти 0,15 події на пацієнта на рік) та значуще зниження річного показника тяжких загострень під час лікування на 20 % (95 % ДІ: 3,34; p = 0,0221) у порівнянні із ДАІ ФОРМ/БУД (частота; 0,13 проти 0,16 події на пацієнта на рік).
В обох дослідженнях у разі застосування лікарського засобу Триксео Аеросфера користь у впливі на загострення спостерігалася у пацієнтів із помірним, тяжким або дуже тяжким ХОЗЛ.
Вплив на функцію легень
У дослідженні ETHOS та KRONOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано покращення функції легень (ОФВ1) під час лікування у порівнянні із ДАІ ФОРМ/ГЛІ та ДАІ ФОРМ/БУД (див. таблицю 1 для ETHOS і таблицю 2 для KRONOS). В обох дослідженнях спостерігався стійкий ефект протягом 24-тижневого періоду лікування та впродовж 52 тижнів у ETHOS.
Таблиця 1
Аналіз функції легень – ETHOS (спірометричне піддослідження)
Показник |
Триксео Аеросфера (N = 747) |
ДАІ ФОРМ/ ГЛІ (N=779) |
ДАІ ФОРМ/ БУД (N=755) |
Середня різниця, 95 % ДІ |
|
Порівняння Триксео Аеросфера та ДАІ ФОРМ/ГЛІ |
Порівняння Триксео Аеросфера та ДАІ ФОРМ/БУД |
||||
Мінімальний ОФВ1 (мл) за 24 тижні, зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) |
129 (6,5) |
86 (6,6) |
53 (6,5) |
43 мл (25; 60) р < 0,0001 |
76 мл (58; 94) р < 0,0001# |
ОФВ1 AUC0-4 за 24 тижні; зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) |
294 (6,3) |
245 (6,3) |
194 (6,3) |
49 мл (31; 66) р < 0,0001# |
99 мл (82; 117) р < 0,0001 |
# p-значення не скориговано з урахуванням множинності у ієрархічному плані тестування.
МНК — метод найменших квадратів, СП — стандартна похибка, ДІ — довірчі інтервали, N — кількість осіб у вибірці «усі рандомізовані пацієнти відповідно до призначеного лікування» (ІТТ-популяція).
Таблиця 2
Аналіз функції легень – KRONOS
Показник |
Триксео Аеросфера (N = 639) |
ДАІ ФОРМ/ГЛІ (N = 625) |
ДАІ ФОРМ/БУД (N = 314) |
ТБХ ФОРМ/БУД (N = 318) |
Середня різниця, 95 % ДІ |
||
Порівняння Триксео Аеросфера та ДАІ ФОРМ/ГЛІ |
Порівняння Триксео Аеросфера та ДАІ ФОРМ/БУД |
Порівняння Триксео Аеросфера та ТБХ ФОРМ/БУД |
|||||
Мінімальний ОФВ1 (мл) за 24 тижні, зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) |
147 |
125 |
73 (9,2) |
88 (9,1) |
22 мл |
74 мл |
59 мл |
(6,5) |
(6,6) |
(4; 39) р = 0,0139 |
(52; 95) р < 0,0001 |
(38; 80) р < 0,0001# |
|||
ОФВ1 AUC0-4 за 24 тижні , зміна середнього значення, обчисленого за МНК, у порівнянні з вихідним рівнем (СП) |
305 |
288 |
201 |
214 |
16 мл |
104 мл |
91 мл |
(8,4) |
(8,5) |
(11,7) |
(11,5) |
(-6; 38) р = 0,1448# |
(77; 131) р < 0,0001 |
(64; 117) р < 0,0001 |
|
# p-значення не скориговано з урахуванням множинності у ієрархічному плані тестування.
МНК — метод найменших квадратів, СП — стандартна похибка, ДІ — довірчі інтервали, N — кількість осіб у вибірці «усі рандомізовані пацієнти відповідно до призначеного лікування» (ІТТ-популяція).
Полегшення симптому
У дослідженні ETHOS вихідні середні показники задишки коливалися в межах 5,8–5,9 у групах лікування. У пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще зменшення вираженості задишки (виміряне за допомогою динамічного індексу задишки (TDI) за 24 тижні) у порівнянні з ДАІ ФОРМ/ГЛІ (0,40 одиниці; 95 % ДІ: 0,24; 0,55; p < 0,0001) та у порівнянні із ДАІ ФОРМ/БУД (0,31 одиниці; 95 % ДІ: 0,15; 0,46; р < 0,0001). Поліпшення підтримувалося протягом 52 тижнів. У дослідженні KRONOS вихідні середні бали задишки коливалися в межах 6,3–6,5 у групах лікування. У пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значне зменшення вираженості задишки за 24 тижні у порівнянні із ТБХ ФОРМ/БУД (0,46 одиниці; 95 % ДІ: 0,16, 0,77; р = 0,0031). Поліпшення у порівнянні із ДАІ ФОРМ/ГЛІ та ДАІ ФОРМ/БУД не досягли статистичної значущості.
Якість життя, обумовлена станом здоров’я
У дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще покращення стану здоров’я пов’язаного з хворобою (відповідно до загального бала за опитувальником госпіталю Святого Георгія для пацієнтів із респіраторними захворюваннями [SGRQ]) за 24 тижні у порівнянні із ДАІ ФОРМ/ГЛІ (покращення -1,62; 95 % ДІ: -2,27, -0,97; p < 0,0001) та у порівнянні з ДАІ ФОРМ/БУД (покращення -1,38, 95 % ДІ: -2,02, -0,73]; р < 0,0001). Покращення підтримувалося протягом 52 тижнів. У дослідженні KRONOS покращення у порівнянні із ДАІ ФОРМ/ГЛІ, ДАІ ФОРМ/БУД та ТБХ ФОРМ/БУД не досягли статистичної значущості.
Частота застосування лікарського засобу для невідкладної допомоги
У дослідженні ETHOS у пацієнтів, що застосовували лікарський засіб Триксео Аеросфера, було зафіксовано значуще зниження частоти застосування лікарського засобу для невідкладної допомоги під час лікування за 24 тижні у порівнянні із ДАІ ФОРМ/ГЛІ (різниця між видами терапії: -0,51 інгаляції/добу; 95 % ДІ: -0,68; -0,34; p < 0,0001) та ДАІ ФОРМ/БУД (різниця між видами терапії: -0,37 інгаляції/добу; 95 % ДІ: -0,54; -0,20; р < 0,0001). Зниження підтримувалося протягом 52 тижнів. У дослідженні KRONOS відмінності у порівнянні із ДАІ ФОРМ/ГЛІ, ДАІ ФОРМ/БУД та ТБХ ФОРМ/БУД не були статистично значущими.
Фармакокинетика
Использование со спейсером
После применения здоровыми добровольцами этого лекарственного средства со спейсером Aerochamber Plus Flow-Vu увеличивалась общая системная экспозиция (измеренная по AUC0-t) будесонида и гликопирония на 33% и 55% соответственно, тогда как экспозиция формотерола оставалась неизменной.
Всасывание
Будесонид
После ингаляционного применения этого лекарственного средства пациентами с ХОБЛ максимальная концентрация (Cmax) будесонида наблюдалась в течение 20–40 минут. Равновесное состояние достигается через 1 день повторного применения этого лекарственного средства, а степень экспозиции примерно в 1,3 раза выше, чем после первой дозы.
Гликопироний
После ингаляционного применения этого лекарственного средства пациентами с ХОБЛ Cmax гликопирония наступала за 6 минут. Равновесное состояние достигается за 3 дня повторного применения этого лекарственного средства, а степень экспозиции примерно в 1,8 раза выше, чем после первой дозы.
Формотерол
После ингаляционного применения этого лекарственного средства пациентами с ХОБЛ Cmax формотерола наблюдалась в течение 40–60 минут. Равновесное состояние достигается за 2 дня повторного приема этого лекарственного средства, а степень экспозиции примерно в 1,4 раза выше, чем после первой дозы.
Распределение
Будесонид
Согласно популяционному фармакокинетическому анализу расчетный мысленный объем распределения будесонида в равновесном состоянии составляет 1200 л. Связывание будесонида с белками плазмы крови составляет примерно 90%.
Гликопироний
Согласно популяционному фармакокинетическому анализу расчетный мысленный объем распределения гликопирония в равновесном состоянии составляет 5500 л. В диапазоне концентраций 2–500 нмоль/л связывание гликопирония с белками плазмы крови колебалось в пределах 43–54%.
Формотерол
Согласно популяционному фармакокинетическому анализу расчетный мысленный объем распределения формотерола в равновесном состоянии составляет 2400 л. В диапазоне концентраций 10–500 нмоль/л связывание формотерола с белками плазмы крови колебалось в пределах 46–58%.
Биотрансформация
Будесонид
Будесонид испытывает значительную (приблизительно до 90%) биотрансформацию во время первого прохождения через печень с образованием метаболитов с низкой глюкокортикостероидной активностью. Глюкокортикостероидная активность основных метаболитов, 6-β-гидрокси-будесонида и 16-а-гидрокси-преднизолона составляет менее 1% от глюкокортикостероидной активности будесонида.
Гликопироний
Согласно данным научной литературы и исследованиям гепатоцитов человека, in vitro метаболизм играет незначительную роль в общем выводе гликопирония. Было обнаружено, что CYP2D6 является предпочтительным ферментом, участвующим в метаболизме гликопиронии.
Формотерол
Основной метаболизм формотерола осуществляется путем прямого глюкуронирования и О деметилирования с последующей конъюгацией с неактивными метаболитами. Вторичные метаболические пути включают деформирование и конъюгацию с сульфатами. Было установлено, что CYP2D6 и CYP2C в первую очередь ответственны за О деметилирование.
Вывод
Будесонид
Будесонид выводится путём метаболизма, преимущественно под действием катализатора, которым выступает фермент CYP3A4. Метаболиты будесонида выводятся с мочой в чистом виде или в конъюгированной форме. В моче были обнаружены лишь незначительные количества неизмененного будесонида. Эффективный конечный период полувыведения будесонида, определяемый с помощью фармакокинетического популяционного анализа, составлял 5 часов.
Гликопироний
После внутривенного введения 0,2 мг гликопирония, меченного радиоактивным изотопом, 85% дозы выводилось с мочой через 48 часов после введения; определенная часть радиоактивности также выводилась с желчью. Эффективный терминальный период полувыведения гликопирония, определенный с помощью популяционного фармакокинетического анализа, составлял 15 часов.
Формотерол
Выведение формотерола изучалось у шести здоровых лиц после одновременного перорального и внутривенного введения формотерола, меченного радиоактивным изотопом. В этом исследовании 62% радиоактивности выводилось с мочой, а 24% — с калом. Эффективный период полувыведения формотерола, определенный с помощью популяционного фармакокинетического анализа, составлял 10 часов.
Особые группы пациентов
Возраст, пол, раса/этническая принадлежность и масса тела
Коррекция дозы не требуется в связи с отсутствием влияния возраста, пола или массы тела пациента на фармакокинетические параметры будесонида, гликопирония и формотерола. Среди здоровых участников японского, китайского и европейского/американского происхождения не было обнаружено значимых отличий в общей системной экспозиции (AUC) всех компонентов препарата. Недостаточно фармакокинетических данных для других этнических групп или рас.
Печеночная недостаточность
Фармакокинетические исследования этого лекарственного средства у пациентов с печеночной недостаточностью не проводили. лись. Однако поскольку будесонид и формотерол выводятся преимущественно с участием печеночного метаболизма, то у пациентов с тяжелым циррозом печени можно ожидать роста концентрации лекарственного средства в плазме крови. Гликопироний обычно выводится из системного кровотока путем почечной экскреции, поэтому не ожидается, что печеночная недостаточность повлияет на его системную экспозицию.
Почечная недостаточность
Исследования по оценке влияния почечной недостаточности на фармакокинетику будесонида, гликопирония и формотерола не проводились.
Влияние почечной недостаточности на экспозицию будесонида, гликопирония и формотерола в течение периода до 24 недель оценивали в популяционном фармакокинетическом анализе. Расчетная скорость клубочковой фильтрации (рШКФ) колебалась в пределах 31–192 мл/мин, что соответствует диапазону от умеренной почечной недостаточности до полного отсутствия почечной недостаточности. Моделирование системной экспозиции (AUC0-12) у пациентов с ХОБЛ с умеренной почечной недостаточностью (рШКФ 45 мл/мин) указывает на приблизительное увеличение уровня гликопирония на 68% по сравнению с пациентами с ХОБЛ с нормальной функцией почек (рШКФ >9 . Выявлено, что функция почек не влияет на экспозицию будесонида или формотерола. У пациентов с ХОБЛ с низкой массой тела и с умеренной или тяжелой почечной недостаточностью системная экспозиция гликопирония может быть примерно вдвое больше.
Показания
Противопоказания
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Клинические исследования взаимодействия этого лекарственного средства с другими лекарственными средствами не проводились, однако вероятность метаболических взаимодействий считается низкой на основании исследований in vitro (см. раздел «Фармакокинетика»).
Формотерол не ингибирует ферменты CYP450 в терапевтически значимых концентрациях (см. раздел «Фармакокинетика»). Будесонид и гликопироний не ингибируют и не индуцируют ферменты CYP450 в терапевтически значимых концентрациях.
Метаболизм будесонида в первую очередь опосредуется действием фермента CYP3A4 (см. раздел «Фармакокинетика»). Ожидается, что при сопутствующем применении мощных ингибиторов CYP3A, таких как итраконазол, кетоконазол, ингибиторы протеазы ВИЧ и лекарственные средства, содержащие кобицистат, увеличивается риск развития системных побочных реакций; такого сопутствующего применения следует избегать, если польза не преобладает повышенным риском развития системных побочных реакций на кортикостероиды. Если все-таки принимается решение о таком сопутствующем применении, пациенты должны находиться под наблюдением системных побочных реакций на кортикостероиды. Это наблюдение имеет ограниченное клиническое значение при краткосрочном (1–2 нед) лечении.
Ограниченные данные по указанным выше видам взаимодействия при применении высоких доз ингаляционной формы будесонида указывают на то, что возможно значительное увеличение плазменных уровней (в среднем в 4 раза), если итраконазол в дозе 200 мг 1 раз в сутки применяется вместе с ингаляционной формой будесонида ( разовая доза (1000 мкг).
Поскольку гликопироний выводится в большинстве своем почками, возможно взаимодействие этого препарата с лекарственными средствами, влияющими на механизмы почечной экскреции.In vitro Гликопироний является субстратом для почечных транспортеров OCT2 и MATE1/2K. Исследование влияния циметидина, маркерного ингибитора OCT2 и MATE1, на распределение ингаляционной формы гликопирония показало ограниченное увеличение его общей системной экспозиции (AUC0-t) на 22% и незначительное снижение почечного клиренса на 23% из-за одновременного введения циметидина.
Фармакодинамические взаимодействия
Другие антимускариновые средства и симпатомиметики
Совместное применение этого лекарственного средства с другими лекарственными средствами, содержащими антихолинергические и/или β2-агонисты длительного действия, не изучалось и не рекомендуется, так как оно может усиливать известные побочные реакции на ингаляционные антагонисты мускариновых рецепторов или β2-агонистов (см. Особенности применения» и «Передозировка»).
При одновременном применении других β-адренергических лекарственных средств могут отмечаться потенциально аддитивные эффекты; поэтому следует соблюдать осторожность, назначая другие β-адренергические лекарственные средства одновременно с формотеролом.
Гипокалиемия, вызванная лекарственными средствами
Возможна начальная гипокалиемия, которая может усиливаться при сопутствующем применении лекарственных средств, включая производные ксантина, кортикостероиды и диуретики, не являющиеся калийсберегающими (см. раздел «Особенности применения»). Гипокалиемия может усилить склонность к аритмии у пациентов, получающих гликозиды наперстянки.
β-адреноблокаторы
β-адреноблокаторы (в том числе глазные капли) могут ослаблять или угнетать действие формотерола. Следует избегать одновременного применения β-адреноблокаторов, за исключением случаев, когда ожидаемая польза превышает потенциальные риски. Если нужны β-адреноблокаторы, предпочтение отдается кардиоселективным средствам этого класса.
Другие фармакодинамические взаимодействия
При одновременном применении хинидина, дизопирамида, прокаинамида, антигистаминных лекарственных средств, ингибиторов моноаминооксидазы, трициклических антидепрессантов и фенотиазина может удлиняться интервал QT и повышаться риск возникновения желудочковых аритмий. Кроме того, L-допа, L-тироксин, окситоцин и алкоголь могут ухудшать толерантность сердца к β2-симпатомиметикам.
Сопутствующее применение ингибиторов моноаминооксидазы, включая лекарственные средства с подобными свойствами, такими как фуразолидон и прокарбазин, может провоцировать гипертонические реакции.
У пациентов, получающих сопутствующую анестезию с использованием галогенированных углеводородов, существует повышенный риск аритмии.
Особенности применения
Это лекарственное средство не показано для лечения острых эпизодов бронхоспазма, то есть для неотложной помощи.
Парадоксальный бронхоспазм
Применение формотерола/гликопирония/будесонида может вызвать парадоксальный бронхоспазм с внезапным свистящим дыханием и одышкой после введения дозы; такое состояние может быть опасным для жизни. Терапию этим лекарственным средством следует немедленно прекратить в случае возникновения парадоксального бронхоспазма. Пациента, у которого возник парадоксальный бронхоспазм, следует обследовать и в случае необходимости назначить альтернативную терапию.
Ухудшение протекания заболевания
Не рекомендуется резко прекращать терапию этим лекарственным средством. Если пациенты считают лечение неэффективным, следует продолжить лечение, обратившись за медицинской помощью. Если пациенту приходится все чаще применять бронхолитик для облегчения симптомов, это указывает на ухудшение основного заболевания и необходимость пересмотра схемы лечения. Внезапное и прогрессирующее ухудшение симптомов ХОБЛ потенциально чревато для жизни, поэтому пациенту нужно срочно пройти медицинское обследование.
Воздействие на сердечно-сосудистую систему
После введения антагонистов мускариновых рецепторов и симпатомиметиков, включая гликопиронию и формотерол, могут наблюдаться сердечно-сосудистые эффекты, такие как нарушения сердечного ритма, например фибрилляция предсердий и тахикардия. Это лекарство нужно применять с осторожностью пациентам с клинически значимыми неконтролируемыми и тяжелыми сердечно-сосудистыми заболеваниями, такими как нестабильная ишемическая болезнь сердца, острый инфаркт миокарда, кардиомиопатия, нарушения ритма сердца и тяжелая сердечная недостаточность.
Следует также быть осторожными, леча пациентов с известным или подозреваемым удлинением интервала QTc (QTc > 450 мс у мужчин или > 470 мс у женщин), независимо от того, является ли это нарушение врожденным или вызванным лекарственными средствами.
Системные эффекты кортикостероидов
Системные эффекты могут возникать при применении любых ингаляционных кортикостероидов, особенно при высоких дозах в течение длительного периода. Вероятность возникновения таких эффектов намного меньше при применении ингаляционных форм кортикостероидов по сравнению с пероральными. К возможным системным эффектам относятся синдром Кушинга, кушингоидные признаки, угнетение функции надпочечников, снижение минеральной плотности костной ткани, катаракта и глаукома. Следует учитывать возможное влияние лекарственного средства на минеральную плотность костной ткани, особенно у пациентов, применяющих лекарственное средство в высоких дозах в течение длительного периода и имеющих сопутствующие факторы риска остеопороза.
Нарушение зрения
При системном и местном применении кортикостероидов могут быть зарегистрированы случаи нарушения зрения. Если у пациента есть такие симптомы, как размытость зрения или другие нарушения зрения, его следует направить на консультацию к офтальмологу для установления возможной причины, которой может быть катаракта, глаукома или редкие заболевания, в частности центральная серозная хориоретинопатия; такие нарушения зрения были зарегистрированы после применения системных и местных кортикостероидов (см. «Побочные реакции»).
Переход с пероральной терапии
Особое внимание необходимо при лечении пациентов, которые переходят с перорального применения кортикостероидов, поскольку у них на протяжении значительного времени может сохраняться риск нарушения функции надпочечников. Пациенты, требующие высокодозовой терапии кортикостероидами или длительного лечения ингаляционными кортикостероидами в наивысшей рекомендуемой дозе, также могут быть в группе риска. У таких пациентов при сильном стрессе могут возникать симптомы надпочечниковой недостаточности. Во время периодов стресса или в случае плановых хирургических вмешательств следует рассмотреть возможность дополнительного лечения системными кортикостероидами.
Пневмония у пациентов с ХОБЛ
У пациентов с хроническим обструктивным заболеванием легких (ХОБЛ), получающих ингаляционные кортикостероиды, наблюдалось повышение частоты случаев пневмонии, включая пневмонию, требующую госпитализации. Существует ряд доказательств повышенного риска возникновения пневмонии при повышении дозы кортикостероида, однако это не было окончательно продемонстрировано ни в одном из исследований.
Для ингаляционных кортикостероидов отсутствуют исчерпывающие клинические доказательства разногласий по величине риска развития пневмонии.
Врачам следует быть внимательными относительно возможного развития пневмонии у пациентов с ХОБЛ, поскольку клинические признаки этого инфекционного заболевания совпадают с симптомами обострения ХОБЛ.
Факторы риска развития пневмонии у пациентов с ХОБЛ включают курение, пожилой возраст, низкий индекс массы тела (ИМТ) и тяжелое ХОБЛ.
Гипокалиемия
При применении β2-агонистической терапии возможно развитие потенциально серьезной гипокалиемии. Она может привести к побочным реакциям со стороны сердечно-сосудистой системы. Особая осторожность рекомендуется в случае тяжелого ХОБЛ, поскольку этот эффект может усиливаться гипоксией. Гипокалиемия также может усиливаться при одновременном применении этого лекарственного средства с другими лекарственными средствами, которые могут вызвать гипокалиемию, такими как производные ксантина, стероиды и диуретики (см. Взаимодействие с другими лекарственными средствами и другие виды взаимодействий).
Гипергликемия
Ингаляция β2-агонистов в высоких дозах может приводить к повышению уровня глюкозы в плазме крови. Поэтому во время лечения следует контролировать уровень глюкозы в крови в соответствии с установленными рекомендациями для пациентов с сахарным диабетом.
Сопутствующие заболевания
Это лекарственное средство следует с осторожностью применять пациентам с тиреотоксикозом.
Антихолинергическая активность
Из-за его антихолинергической активности это лекарственное средство следует с осторожностью применять пациентам с симптоматической гиперплазией предстательной железы, задержкой мочи или закрытоугольной глаукомой. Пациенты должны быть проинформированы о признаках и симптомах острой закрытоугольной глаукомы, а также о необходимости прекращения применения этого лекарственного средства и немедленном обращении к врачу в случае появления каких-либо из таких признаков или симптомов.
Одновременное применение этого лекарственного средства с другими лекарственными средствами, содержащими антихолинергические препараты, не рекомендуется (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Почечная недостаточность
Поскольку гликопироний выводится преимущественно почками, пациентам с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин), в том числе пациентам с терминальной стадией почечной недостаточности, требующей диализа, следует назначать это лекарственное средство только в том случае, если ожидаемая польза превышает потенциальные. риски (см. раздел "Фармакокинетика").
Печеночная недостаточность
Пациентам с тяжелой печеночной недостаточностью следует назначать это лекарственное средство только в том случае, если ожидаемая польза превышает потенциальные риски (см. раздел «Фармакокинетика»). Такие пациенты должны находиться под наблюдением возможных побочных реакций.
Способность влиять на скорость реакции при управлении автотранспортом или работе с механизмами
Применение в период беременности или кормления грудью
Данные по применению будесонида, гликопирония и формотерола беременными женщинами отсутствуют или ограничены.
Данные об использовании ингаляционного будесонида более 2500 беременными женщинами указывают на отсутствие повышенного тератогенного риска, связанного с будесонидом. Клинические исследования разовой дозы показали, что очень небольшое количество гликопирония преодолевает плацентарный барьер.
Отсутствует опыт или данные о проблемах безопасности при использовании пропеллента норфлурана (HFA 134a) в период беременности или кормления грудью. Однако исследование влияния HFA 134a на репродуктивную функцию и эмбриофетальное развитие у животных не выявили клинически значимых побочных реакций.
Исследования репродуктивной токсичности этого лекарственного средства на животных не проводились. Было показано, что будесонид влечет за собой эмбриофетальную токсичность у крыс и кроликов; этот эффект присущ лекарственным средствам класса глюкокортикоидов. В очень высоких дозах/при очень высоких уровнях системной экспозиции формотерол вызывал выкидыши, а также снижение массы тела младенца при рождении и постнатальной выживаемости в ранних сроках, тогда как гликопироний не оказывал существенного влияния на репродуктивную функцию.
Назначение этого лекарственного средства беременным женщинам следует рассматривать только в том случае, если ожидаемая польза для матери оправдывает потенциальный риск для плода.
Кормление грудью
Клинико-фармакологическое исследование показало, что будесонид выводится с грудным молоком. Однако он не был обнаружен в плазме крови младенцев. На основании фармакокинетических параметров концентрация будесонида в плазме крови младенца составляет менее 0,17% от концентрации в плазме крови матери. Таким образом, при кормлении грудью детей, матери которых получают терапевтические дозы этого лекарственного средства, не ожидается никаких эффектов от будесонида. Неизвестно, выводится гликопироний и формотерол с грудным молоком. Имеются данные о проникновении гликопирония и формотерола в материнское молоко у крыс.
Назначение этого лекарственного средства кормящим грудью женщинам следует рассматривать только в случае, если ожидаемая польза для матери преобладает любой возможный риск для ребенка.
Фертильность
Исследования на крысах показали неблагоприятное влияние формотерола на фертильность только в дозах, превышающих максимальные дозы для человека. Будесонид и гликопироний не оказывали неблагоприятного влияния на фертильность крыс. Маловероятно, что это лекарственное средство, назначенное в рекомендованных дозах, повлияет на фертильность у людей.
Способ применения и дозы
Рекомендована та максимальна доза становить дві інгаляції двічі на добу (дві інгаляції вранці та дві інгаляції ввечері).
У разі пропуску дози її треба прийняти якнайшвидше, а наступну дозу прийняти у звичайний час. Не потрібно приймати додаткову дозу лікарського засобу для компенсації пропущеної дози.
Особливі групи пацієнтів
Пацієнти літнього віку
Пацієнтам літнього віку корекція дози не потрібна (див. розділ «Фармакокінетика»).
Ниркова недостатність
Цей лікарський засіб можна призначати в рекомендованій дозі пацієнтам із легкою та помірною нирковою недостатністю. Його також можна призначати в рекомендованій дозі пацієнтам із тяжкою нирковою недостатністю або термінальною стадією ниркової недостатності, які потребують діалізу, тільки якщо очікувана користь перевищує потенційні ризики (див. розділи «Особливості застосування» та «Фармакокінетика»).
Печінкова недостатність
Цей лікарський засіб можна призначати в рекомендованій дозі пацієнтам з легкою та помірною печінковою недостатністю. Його також можна призначати в рекомендованій дозі пацієнтам з тяжкою печінковою недостатністю, тільки якщо очікувана користь перевищує потенційні ризики (див. розділи «Особливості застосування» та «Фармакокінетика»).
Спосіб застосування
Для інгаляційного застосування.
Вказівки щодо застосування
Для забезпечення правильного введення лікарського засобу Триксео Аеросфера лікар або інший медичний працівник має показати пацієнтові, як правильно користуватись інгалятором; цей фахівець також повинен регулярно перевіряти правильність техніки проведення інгаляції пацієнтом. Треба рекомендувати пацієнту уважно прочитати інструкцію для медичного застосування та дотримуватися вказівок щодо застосування, наведених у ній.
Примітка: Важливо проінформувати пацієнта:
- Не використовувати інгалятор, якщо вологопоглинач, що знаходиться всередині мішечка з фольги, висипався зі своєї упаковки. Для досягнення найкращих результатів перед використанням інгалятор повинен певний час перебувати при кімнатній температурі.
- Підготувати інгалятор, струснувши його та, спрямовуючи розпилення в повітря, натиснувши на контейнер під тиском чотири рази перед першим застосуванням або двічі, якщо інгалятор не використовувався довше як сім днів, після щотижневого миття або якщо інгалятор падав на підлогу.
- Прополоскати ротову порожнину водою після інгаляції, щоб мінімізувати ризик розвитку орофарингеального кандидозу. Не ковтати.
Під час інгаляції лікарського засобу Триксео Аеросфера частина суспензії виштовхується з аерозольного контейнера. Коли пацієнт вдихає повітря через мундштук, одночасно натискаючи на інгалятор, доза лікарського засобу переміщається за вдихуваним повітрям у дихальні шляхи.
Пацієнти, яким тяжко скоординувати дії натискання на інгалятор з вдиханням, можуть використовувати лікарський засіб Триксео Аеросфера зі спейсером, щоб забезпечити правильне введення лікарського засобу. Триксео Аеросфера можна використовувати зі спейсерними пристроями, включно з Aerochamber Plus Flow-Vu (див. розділ «Фармакокінетика»).
Прочитайте перед використанням інгалятора.
Уважно прочитайте цю інструкцію.
Ваш інгалятор Триксео Аеросфера (далі — інгалятор) може відрізнятися від інгаляторів, які ви використовували раніше.
Важлива інформація
- Тільки для інгаляційного застосування.
- Підготуйте інгалятор до першого використання.
- Промивайте жовтий дозатор щотижня.
- Застосовуйте 2 інгаляції лікарського засобу вранці та 2 інгаляції ввечері.
Частини інгалятора
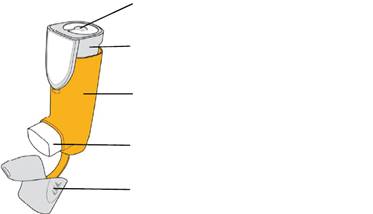 |
Індикатор кількості інгаляцій Прикріплений до верхньої частини контейнера під тиском. |
Контейнер під тиском (всередині) Містить лікарський засіб. |
|
Дозатор Містить контейнер під тиском. |
|
Мундштук Розпилює лікарський засіб. |
|
Ковпачок мундштука Захищає мундштук, коли інгалятор не використовується. |
|
Показання індикатором кількості інгаляцій
Індикатор кількості інгаляцій буде відраховувати 1 дозу кожен раз, коли ви розпилюєте лікарський засіб.
Покажчик доз Вказує на кількість інгаляцій, що залишилися. |
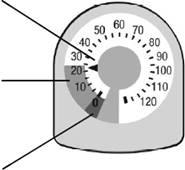 |
Жовта зона Замовте новий інгалятор, коли покажчик знаходиться в жовтій зоні. |
|
Червона зона Викиньте інгалятор, коли покажчик знаходиться на відмітці 0 в червоній зоні |
Не намагайтеся зробити інгаляцію, коли покажчик знаходиться на відмітці 0, оскільки ви не отримаєте повну дозу.
Замовлення нового інгалятора
- Замовте новий інгалятор, коли покажчик індикатора кількості інгаляцій знаходиться в жовтій зоні.
Викидання інгалятора
Викиньте інгалятор, дотримуючись місцевих інструкцій, якщо:
- індикатор кількості інгаляцій показує 0
або
- через 3 місяці після того, як інгалятор був витягнутий з мішечка із фольги.
Не використовуйте повторно та не використовуйте дозатор з контейнерами з лікарськими засобами від інших інгаляторів.
Не проколюйте та не кидайте контейнер під тиском у вогонь чи сміттєспалювач.
ПЕРЕД ПЕРШИМ ВИКОРИСТАННЯМ ̶ перед першим використанням інгалятор необхідно активувати 4 рази
- Перед першим використанням інгалятора активуйте його, щоб отримати потрібну кількість лікарського засобу під час його використання.
Активація. Крок 1 |
Зніміть ковпачок мундштука. |
 |
Активація. Крок 2 |
|||
Добре струсіть інгалятор і зробіть 1 тестове розпилення у повітря у напрямку від себе. Повторіть загалом 4 тестові розпилення, струшуючи інгалятор перед кожним тестовим розпиленням. |
|||

|
 |
||
Додаткові дози передбачені для підготовки інгалятора Не пропускайте етап підготовки. |
|||
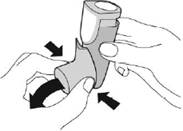
Повторно підготуйте інгалятор до використання:
|
Для повторної підготовки розпиліть 2 тестових розпилення, струшуючи інгалятор перед кожним тестовим розпиленням. |
||
|
|
||
|
ЩОДЕННЕ ВИКОРИСТАННЯ ̶ вранці та ввечері застосовуйте лікарський засіб.
- Добова доза: 2 інгаляції вранці та 2 інгаляції ввечері.
- Прополощіть ротову порожнину водою після 2 інгаляцій, щоб запобігти грибковій інфекції.
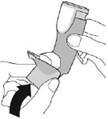
Крок 1 |
Зніміть ковпачок мундштука. Перевірте мундштук на наявність сторонніх предметів і видаліть предмети перед використанням. |
 |
Крок 2 |
||||
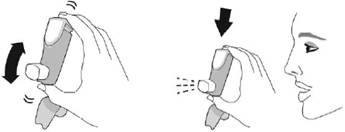
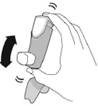
Перед кожною інгаляцією добре струсіть інгалятор. |
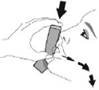
Повністю видихніть. |
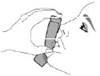
Помістіть мундштук у рот і зімкніть губи навколо мундштука. Нахиліть голову назад, утримуючи язик під мундштуком. |
Почніть глибоко і повільно вдихати, роблячи 1 інгаляцію. Продовжуйте вдихати, поки більше не зможете вдихнути. |
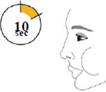
Затримайте дихання якомога довше, до 10 секунд. |
 |
 |
 |
 |
 |
Крок 3 |
Крок 4 |
Крок 5 |
|
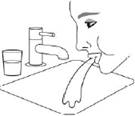
 |
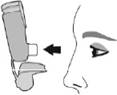
Знову надіньте ковпачок на мундштук. |
Прополощіть ротову порожнину водою. Виплюньте воду. Не ковтайте. |
|
 |
 |
||
ЩОТИЖНЕВЕ ПРОМИВАННЯ — промивайте дозатор раз на тиждень
- Щотижня промивайте жовтий дозатор, щоб лікарський засіб не накопичувався і не блокував розпилення через мундштук.
- Не допускайте намокання контейнера.
- Повторно підготуйте інгалятор до використання після промивання.
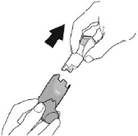
Промивання. Крок 1 |
Промивання. Крок 2 |
Зніміть контейнер та відкладіть. Не допускайте намокання контейнера. |
Зніміть ковпачок мундштука. |
 |
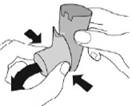 |
Промивання. Крок 3 |
Промивання. Крок 4 |
Пропустіть теплу воду через мундштук протягом 30 секунд, а потім через верхню частину дозатора протягом 30 секунд. Промивайте загалом 60 секунд. 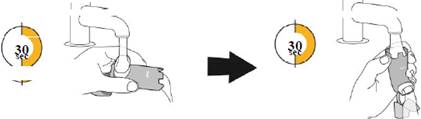 |
Струсіть стільки води, скільки зможете. 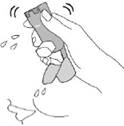 Не сушіть рушником або серветкою. |
Промивання. Крок 5 |
Промивання. Крок 6 |
Подивіться всередину дозатора і мундштука щодо накопичення лікарського засобу. Якщо є будь-які накопичення, повторіть кроки промивання з 3 по 5. |
Висушіть на повітрі, бажано протягом ночі. Не вставляйте контейнер у дозатор, якщо він все ще вологий. |
 |
 |
Промивання. Крок 7 |
Промивання. Крок 8 |
||
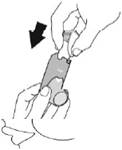
Коли він висохне, спочатку встановіть ковпачок мундштука, а потім обережно вставте контейнер у дозатор. |
Зробіть повторну підготовку шляхом проведення 2 тестових розпилень, струшуючи інгалятор перед кожним тестовим розпиленням. |
||
 |
|
Дети
Передозировка
Специфическое лечение при передозировке этим лекарственным средством отсутствует. При передозировке пациенту необходимо проводить поддерживающую терапию с надлежащим контролем, если необходимо.
Побочные реакции
Профиль безопасности этого лекарственного средства характеризуется эффектами, характерными для кортикостероидов, антихолинергических средств и β2-агонистов, так как к таким классам лекарственных средств относятся отдельные компоненты этого комбинированного лекарственного средства. Наиболее частыми побочными реакциями у пациентов, применявших это лекарственное средство, были пневмония (4,6%), головная боль (2,7%) и инфекция мочевыводящих путей (2,7%).
Список побочных реакций в форме таблицы
Список побочных реакций в форме таблицы основывается на опыте применения этого лекарственного средства в клинических испытаниях и опыте применения его отдельных компонентов.
Представленные ниже побочные реакции приведены по классам систем органов и по частоте их проявления: очень часто (≥ 1/10), часто (≥ 1/100 до < 1/10), нечасто (≥ 1/1000 до < 1/100), редко (≥ 1/10 000 до < 1/1000), очень редко (< 1/10 000), частота неизвестна (невозможно оценить из-за имеющихся данных).
Таблица 3
Побочные реакции, классифицированные в группы по частоте и классу системы органов (КСО)
Клас системи органів (КСО) |
Побічна реакція на застосування лікарського засобу |
Частота |
Інфекційні та паразитарні захворювання |
Кандидоз ротової порожнини, пневмонія |
Часто |
З боку імунної системи |
Гіперчутливість |
Нечасто |
Ангіоневротичний набряк |
Частота невідома |
|
З боку ендокринної системи |
Ознаки або симптоми системного впливу глюкокортикостероїдів, наприклад гіпофункція надниркових залоз |
Дуже рідко |
З боку обміну речовин і харчування |
Гіперглікемія |
Часто |
Психічні порушення |
Тривожність, безсоння |
Часто |
Депресія, збудження, занепокоєння, підвищена збудливість |
Нечасто |
|
Ненормальна поведінка |
Дуже рідко |
|
З боку нервової системи |
Головний біль |
Часто |
Запаморочення, тремор |
Нечасто |
|
З боку органів зору |
Затуманений зір (див. розділ «Особливості застосування»), катаракта, глаукома |
Частота невідома |
З боку серця |
Посилене серцебиття |
Часто |
Стенокардія, тахікардія, порушення ритму серця (наприклад фібриляція передсердь, надшлуночкова тахікардія та екстрасистолія) |
Нечасто |
|
З боку органів дихання, грудної клітки та середостіння |
Дисфонія, кашель |
Часто |
Подразнення горла, бронхоспазм |
Нечасто |
|
З боку шлунково-кишкового тракту |
Нудота |
Часто |
Сухість у роті |
Нечасто |
|
З боку шкіри та підшкірної клітковини |
Утворення синців |
Нечасто |
З боку скелетно-м’язової та сполучної тканини |
М’язові спазми |
Часто |
З боку нирок і сечовивідних шляхів |
Інфекції сечовивідних шляхів |
Часто |
Затримка сечі |
Нечасто |
|
Порушення загального характеру та реакції в місці введення |
Біль у грудній клітці |
Нечасто |
Описание отдельных побочных реакций
Пневмония
KRONOS - это 24-недельное исследование, в котором приняли участие 1896 пациентов с ХОБЛ умеренной, тяжелой или очень тяжелой степени (на момент скрининга средний ОФВ1 после применения бронхолитика составлял 50% от прогнозируемого значения, стандартное отклонение [СВ] 14%), из которых перенесли обострение ХОБЛ в течение года, предшествовавшего зачислению в исследование. Частота подтвержденных случаев пневмонии, зарегистрированных за 24 недели, равнялась 1,9 % (12 пациентов) в группе Триксео Аэросфера (n = 639), 1,6 % (10 пациентов) в группе дозировочного ингалятора (ГАИ) формотерола фумарата дигидрата/гликоп. ФОРМ/ГЛИ) 5/7,2 мкг (n = 625), 1,9 % (6 пациентов) в группе ГАИ формотерола фумарата дигидрата/будесонида (ФОРМ/СТР) 5/160 мкг (n = 314) и 1,3 % (4 пациента) в группе турбухалера (ТБХ) формотерола фумарата дигидрата/будесонида (ФОРМ/СТР) 6/200 мкг (n = 318). В исследовании KRONOS не было смертельных случаев пневмонии во время применения лекарственного средства Триксео Аэросфера.
ETHOS — это 52-недельное исследование, в котором приняли участие 8529 пациентов (в популяции для оценки безопасности) с ХОБЛ умеренной, тяжелой или очень тяжелой степени или тяжелыми обострениями в анамнезе в течение предыдущих 12 месяцев (на момент скрининга средний ОФВ1 после применения % от прогнозируемого значения, СО 10 %). Частота подтвержденных случаев пневмонии равнялась 4,2% (90 пациентов) в группе Триксео Аэросфера (n = 2144), 3,5% (75 пациентов) в группе ГАИ формотерола фумарата дигидрата/гликопирония/будесонида (ФОРМ/ГЛИ/БУ) 7,2/80 мкг (n = 2124), 2,3 % (48 субъектов) в группе ГАИ ФОРМ/ГЛИ 5/7,2 мкг (n = 2125) и 4,5 % (96 субъектов) в группе ГАИ ФОРМ/СТРОЙ 5/160 мкг (n = 2136). В исследовании ETHOS было зарегистрировано пять смертельных случаев пневмонии во время этапа лечения (два в группе ГАИ ФОРМ/ГЛИ/СТР 5/7,2/80 мкг, три в группе ГАИ ФОРМ/ГЛИ и ни одного в группе Триксео Аэросфера).
Срок годности
Использовать в течение 3 месяцев после вскрытия мешочка из фольги.
Условия хранения
Хранить в сухом месте.
Упаковка
Категория отпуска
Производитель
Местонахождение производителя и его адрес места осуществления деятельности
Источник инструкции
Обратите внимание!
Описание лекарственного средства на этой странице носит исключительно информационный характер. Для того чтобы правильно выбрать препарат для лечения вашего заболевания, обращайтесь к врачу.
Самолечение может повредить вашему здоровью!
ᐉ Онлайн-аптека Подорожник • Заказ лекарств онлайн с доставкой • Сеть аптек по всей Украине не несет ответственности за некорректное использование информации, размещенной на сайте, и возможные негативные последствия этого. Детальнее отказ от ответственности.

