- Основное
- Наличие в аптеках
- Инструкция
- Написать отзыв
Инлита таблетки по 1 мг, 56 шт.
Получите AI аналитику по товару Инлита таблетки по 1 мг, 56 шт.:
Аллергикам | |
Водителям | |
Беременным | |
Кормящим матерям | |
Детям | |
Температура хранения | |
Рецептурный отпуск |
Свойства препарата Инлита таблетки по 1 мг, 56 шт.
Основные
| Действующее вещество | |
| Торговое название | |
| Категория | |
| GTIN | 4034541010491 |
| Страна производитель | Германия |
| Импортный | Да |
| Дозировка | 1 мг |
| Первичная упаковка | Блистер |
| Международное наименование | Axitinib |
| Температура хранения | от 5 °С до 25 °С |
| Срок годности | 3 года |
| Код АТС/ATX | L01X E17 |
| Рецептурный отпуск | по рецепту |
| Форма выпуска | Таблетки |
| Кол-во в упаковке | 56 |
| Упаковка | По 14 таблеток в блистере, по 4 блистера в картонной коробке |
| Код Морион | 188966 |
| Способ введения | орально |
| Производитель |
Кому можна
| Аллергикам | с осторожностью |
| Водителям | с осторожностью |
| Беременным | с осторожностью |
| Кормящим матерям | с осторожностью |
| Детям | запрещено |
Перед публикацией Ваш отзыв может быть отредактирован для исправления грамматики, орфографии или удаления неприемлемых слов и контента. Отзывы, которые, как нам кажется, созданы заинтересованными сторонами, не будут опубликованы. Старайтесь рассказывать о собственном опыте, избегая обобщений.
Инлита таблетки по 1 мг, 56 шт. - Инструкция по применению
Обратите внимание!
Цель Программы – сделать лекарственные средства группы компаний Пфайзер, участвующих в Программе и назначенных лечащим врачом более доступными для всех пациентов.
Состав
1 таблетка, покрытая пленочной оболочкой, содержит 1 мг аксинтиниба;
другие составляющие: целлюлоза микрокристаллическая; лактоза, моногидрат; натрия кроскармелоза; магния стеарат; Opadry® II красный 32K15441 (HPMC 2910/гипромелоза 15сР; титана диоксид (Е 171); лактоза, моногидрат; триацетин; железа оксид красный (Е 172)).
Лекарственная форма
Основные физические и химические свойства: красная овальная таблетка, покрытая пленочной оболочкой, с гравировкой Pfizer с одной стороны и 1 и XNB с другой.
Фармакотерапевтическая группа
Фармакодинамика
Было установлено, что аксинитин в терапевтических концентрациях в плазме крови ингибирует рецепторы тирозинкиназы, в том числе рецепторы сосудистого эндотелиального фактора роста СЕФР-1, СЕФР-2 и СЕФР-3. Эти рецепторы задействованы в патологическом ангиогенезе, процессах роста опухоли и прогрессировании злокачественных новообразований. Аксытиниб ингибировал обусловленные влиянием СЕФР пролиферацию и выживание эндотелиальных клеток in vitro и на моделях мышей. На моделях ксенотрансплантатов опухолей мышей было показано, что аксилитин подавляет рост опухолей и фосфорилирование СЕФР-2.
Для оценки влияния разовой пероральной дозы Инлита (5 мг) на продолжительность интервала QTc в случае применения с 400 мг кетоконазола и в качестве монотерапии было проведено рандомизированное слепое перекрестное исследование с двумя периодами, в котором принимали участие 35 здоровых добровольцев. В течение первых 3 часов после приема препарата не наблюдалось заметных изменений средней продолжительности интервала QTc (т.е. более 20 мс) по сравнению с группой плацебо. В то же время, нельзя исключить вероятность незначительного удлинения средней продолжительности интервала QTc (т.е. менее чем на 10 мс).
Фармакокинетика
Всасывание и распределение. Средний Tmax после перорального приема разовой дозы 5 мг колебался в пределах от 2,5 до 4,1 часа. В зависимости от длительности периода полувыведения из плазмы достижение равновесного состояния ожидается через 2–3 дня приема препарата. Прием аксинитина в режиме 5 мг дважды в день приводил к примерно в 1,4 раза более интенсивному накоплению препарата по сравнению с приемом разовой дозы. Фармакокинетика аксинитина в равновесном состоянии почти линейна в пределах диапазона доз от 1 до 20 мг. Средняя абсолютная биодоступность аксинтиниба после перорального приема разовой дозы 5 мг составляет 58%.
Прием препарата Инлита с умеренно обогащенной жирами пищей приводил к снижению AUC примерно на 10% по сравнению с таковой при приеме препарата натощак утром. В результате приема с обогащенной жирами высококалорийной пищей AUC препарата возрастала на 19% по сравнению с таковой при приеме препарата натощак утром. Препарат Инлита можно принимать как с пищей, так и независимо от еды (см. «Способ применения и дозы»).
Акситиниб почти полностью (более чем на 99%) связывается с белками плазмы крови человека, преимущественно взаимодействуя с альбумином и умеренно связываясь с α1-кислым гликопротеином. У пациентов с распространенной почечноклеточной карциномой (n = 20), принимавших препарат в дозе 5 мг дважды в день после еды, геометрические средние значения Cmax и AUC0-24 равны 27,8 нг/мл (79%) и 265 нг.ч/ мл (77%) соответственно. Клиренс и объем распределения равнялись 38 л/ч (80 %) и 160 л (105 %) соответственно (в скобках указаны значения КВ в %).
Метаболизм и выведение. Период полувыведения Инлита из плазмы крови колеблется от 2,5 до 6,1 часа. Метаболизм аксинитина происходит преимущественно в печени за счет CYP3A4/5. В меньшей степени участие в метаболизме аксинтиниба принимают CYP1A2, CYP2C19 и UGT1A1. После перорального приема 5 мг радиоактивно меченого аксинтиниба примерно 41% радиоактивности выводится из организма с калом и примерно 23% с мочой. Основным компонентом, обнаруженным в кале, был неизмененный аксинитин в количестве, соответствующем 12% принятой дозы. В моче неизмененный аксилитин отсутствует. Большая часть радиоактивности в моче обусловлена наличием карбоксильного и сульфоксидного метаболитов действующего вещества. Основным радиоактивным компонентом плазмы является N-глюкуроновый метаболит, обеспечивающий 50% циркулирующей радиоактивности плазмы. Неизмененный аксилитин и сульфоксидный метаболит обеспечивают примерно по 20% циркулирующей в плазме радиоактивности.
Родство сульфоксидного и N-глюкуронового метаболитов in vitro с рецепторами СЕФР-2 примерно в ≥400 раз ниже родства аксинтиниба.
Влияние других препаратов на препарат Инлита. Метаболизм аксинитина происходит в первую очередь в печени под действием фермента CYP3A4/5. Кроме того, растворимость аксинитина в воде зависит от рН: с повышением рН растворимость снижается. Воздействие мощного ингибитора CYP3A4/5, мощного индуктора CYP3A4/5 и антацида на фармакокинетику акситиниба отражено в таблице 1 (см. также разделы «Способ применения и дозы» и «Взаимодействие с лекарственными средствами и другие виды взаимодействий»)
Таблица 1
Влияние на фармакокинетику аксинитина лекарственных препаратов, которые применяют одновременно с ним, и нарушение функций печени
Характеристика популяции |
ФК |
Диапазон изменений и 90% ДИ |
Рекомендации |
Мощный ингибитор CYP3A4/5: кетоконазол 400 мг 1 р/сут в течение 7 дней |
Cmax AUC |
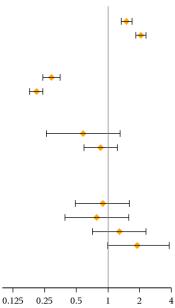 |
Снизить дозу Инлиты* |
Мощный индуктор CYP3A4/5: рифампин 600 мг 1 р/сут в течение 9 дней |
Cmax AUC |
Уникати призначення |
|
Антацид: рабепрозол 20 мг 1 р/сут в течение 5 дней |
Cmax AUC |
Коррекция дозы не требуется |
|
Нарушение функций печени |
|||
Легкое/норма |
Cmax AUC |
Коррекция дозы не требуется |
|
Умеренное/норма |
Cmax AUC |
Снизить дозу Инлиты* |
|
Тяжелое/норма |
Опыт отсутствует |
||
AUC – площадь под кривой зависимости концентрации препарата от времени.
Cmax – максимальная концентрация.
*См. См. раздел «Способ применения и дозы».
ФК – фармакокинетика.
ДИ – доверительный интервал.
Фармакокинетика у особых групп пациентов
Дети. Не проводилось исследований препарата Инлита с участием пациентов в возрасте до 18 лет.
Нарушение функций печени. Влияние на нарушение функции печени на фармакокинетику аксинитина отражено в таблице 1 (см. также разделы «Способ применения и дозы», «Особенности применения»).
Нарушение функции почек. Проведен популяционный анализ фармакокинетики с участием 590 здоровых добровольцев и пациентов на основе показателей функционирования почек. Среди проанализированных пациентов пятеро имели нарушение функции почек тяжелой степени (клиренс креатинина в диапазоне от 15 до <29 мл/мин), у 64 пациентов были нарушения средней степени тяжести (от 30 до <59 мл/мин) и у 139 пациентов нарушение функции почек легкой степени (клиренс креатинина от 60 до <89 мл/мин). Нарушения функции почек от легкой до тяжелой степени не оказывают существенного влияния на фармакокинетику аксинитина. Данные о применении препарата при терминальных поражениях почек доступны только одному пациенту.
Другие факторы индивидуального характера. Результаты популяционного анализа фармакокинетики свидетельствуют об отсутствии клинически важного влияния возраста, пола, расы, массы и площади поверхности тела, генотипа UGT1A1 или генотипа CYP2C19 на клиренс аксинитина.
Показания
Противопоказания
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Одновременное применение кетоконазола (мощный ингибитор CYP3A4/5) повышало уровни экспозиции окситиниба в плазме крови здоровых добровольцев. Следует избегать одновременного применения Инлита с мощными ингибиторами CYP3A4/5. Употребление грейпфрута или грейпфрутового сока также может повышать концентрацию аксинитина в плазме. Сочетание этих продуктов с аксинитином также следует избегать. Рекомендуется подбирать сопутствующее лекарственное средство с отсутствующим или минимальным потенциальным угнетением активности CYP3A4/5. Если необходимо назначать препарат Инлита одновременно с мощным ингибитором CYP3A4/5, дозу аксинитина необходимо снизить (см. раздел «Способ применения и дозы» и «Фармакокинетика»).
Ингибиторы CYP1A2 и CYP2C19
CYP1A2 и CYP2C19 принимают незначительное участие (< 10%) в метаболизме акситиниба. Влияние сильных ингибиторов этих изоферментов на фармакокинетику аксинитина не исследовалось. Из-за риска повышения уровня аксинтиниба в плазме крови следует соблюдать осторожность при одновременном применении сильных ингибиторов вышеуказанных изоферментов.
Индукторы CYP3A4/5
Одновременное применение рифампина (мощный индуктор CYP3A4/5) снижало уровни экспозиции аксинтиниба в плазме крови здоровых добровольцев. Следует избегать одновременного назначения препарата Инлита и мощных индукторов CYP3A4/5 (таких как рифампин, дексаметазон, фенитоин, карбамазепин, рифабутин, рифапентин, фенобарбитал, зверобой). Для одновременного применения с препаратом Инлита рекомендуется подбирать препарат с отсутствующим или минимальным потенциалом индуцирования активности CYP3A4/5. Умеренные индукторы CYP3A4/5 (такие как босентан, эфавиренц, этравирин, модафинил и нафциллин) также могут снижать уровни экспозиции аксинтиниба в плазме. Применение этих препаратов тоже по возможности следует избегать.
In vitro исследования ингибирования и индукции CYP и UGT
In vitro исследования показали, что аксинтиниб не ингибирует CYP2A6, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4/5 и UGT1A1 в терапевтических концентрациях в плазме крови.
Исследования in vitro показали, что аксинтин может потенциально ингибировать CYP1A2. Поэтому одновременное применение аксинитина с субстратами CYP1A2 может привести к повышенному уровню субстратов CYP1A2 (таких как теофиллин) в плазме крови.
In vitro исследования также показали, что аксилитин может потенциально ингибировать CYP2C8. Однако одновременное применение аксинитина с паклитакселом, известным субстратом CYP2C8, не приводило к повышению концентрации паклитаксела в плазме крови у пациентов с распространенным раком, что свидетельствует об отсутствии клинически значимого ингибирования CYP2C8.
In vitro исследования на гепатоцитах человека также продемонстрировали, что аксинтин не индуцирует CYP1A1, CYP1A2 и CYP3A4/5. Поэтому ожидается, что одновременное применение аксинитина не будет снижать уровни субстратов CYP1A1, CYP1A2 и CYP3A4/5 в плазме крови in vivo.
In vitro исследования с P-гликопротеином
In vitro исследования показали, что аксинтиниб ингибирует P-гликопротеин. Однако ожидается, что акситинин не будет оказывать ингибирующее влияние на P-гликопротеин в терапевтических концентрациях в плазме крови. Поэтому предполагается, что одновременное применение аксинтиниба не повышает концентрацию дигоксина или других субстратов P-гликопротеина в плазме крови in vivo.
Особенности применения
До начала лечения препаратом Инлита следует обеспечить надлежащий контроль АД. Следует наблюдать за состоянием пациента для выявления признаков артериальной гипертензии и при необходимости проводить лечение стандартными гипотензивными препаратами. В зависимости от степени тяжести АГ следует либо временно приостановить применение препарата Инлита с последующим уменьшением дозы, либо окончательно прекратить эту терапию (см. Способ применения и дозы).
Артериальная тромбоэмболия
Применение препарата Инлита для лечения пациентов, у которых на протяжении предыдущих 12 месяцев наблюдалась артериальная тромбоэмболия, не исследовали. В ходе клинических исследований с применением препарата Инлита у 17 из 715 пациентов (2 %) были зарегистрированы случаи артериальной тромбоэмболии (включая транзиторные ишемические атаки, нарушение мозгового кровообращения, инфаркт миокарда и окклюзию артерии после случаи). кровообращения.
При возникновении артериальной тромбоэмболии во время лечения следует прекратить применение препарата Инлита.
Венозная тромбоэмболия
В ходе клинических исследований сообщалось о случаях венозной тромбоэмболии (ВТЭ) (в том числе эмболии легочной артерии, тромбоза глубоких вен, окклюзии и тромбоза вен сетчатки), в т. ч. с летальным исходом.
Применение препарата Инлита для лечения пациентов, у которых на протяжении предыдущих 6 месяцев наблюдалась венозная тромбоэмболия, не исследовали. В ходе клинических исследований с применением препарата Инлита у 22 из 715 пациентов (3%) были зарегистрированы случаи венозной тромбоэмболии, в том числе два случая с летальным исходом после тромбоэмболии легочной артерии.
Необходимо проводить мониторинг о наличии признаков и симптомов ВТЭ и тромбоэмболии легочной артерии. В зависимости от степени тяжести ВТЭ следует либо временно приостановить применение Инлита с последующим его восстановлением без изменения дозы, либо окончательно прекратить такую терапию.
Повышение гемоглобина или гематокрита
Во время лечения аксинитином возможно повышение гемоглобина или гематокрита, что отражает увеличение массы эритроцитов. Увеличение массы эритроцитов может увеличить риск эмболических и тромботических явлений.
Гемоглобин или гематокрит следует контролировать до начала и периодически на протяжении всего лечения аксинитином. Если гемоглобин или гематокрит превышают нормальный уровень, пациентам следует назначить лечение в соответствии со стандартной медицинской практикой для снижения уровня гемоглобина или гематокрита до приемлемого уровня.
Кровотечение
Сообщалось о возникновении кровотечений, таких как кровоизлияния в мозг, гематурия, кровохарканье, кровотечения из нижних отделов пищеварительного тракта и мелена, кровотечение с летальным исходом.
Применение препарата Инлита пациентам с признаками наличия нелеченных метастазов в головном мозге или недавнего активного кровотечения из пищеварительного тракта не исследовали. Таким пациентам не следует назначать этот препарат. В зависимости от степени тяжести и стойкости кровотечения следует либо временно приостановить применение Инлита с последующим уменьшением дозы, либо окончательно прекратить такую терапию.
Сердечная недостаточность
В рамках контролируемого клинического исследования применения препарата Инлита для лечения пациентов с почечноклеточным раком сердечная недостаточность наблюдалась у 6/359 пациентов (2%), получавших препарат Инлита, и у 3/355 пациентов (1%), получавших сорафениб. Сердечная недостаточность степени 3/4 наблюдалась у 2/359 пациентов (1%), получавших препарат Инлита, и у 1/355 пациентов (<1%), получавших сорафениб. Сердечная недостаточность с летальным исходом наблюдалась у 2/359 пациентов (1%), получавших препарат Инлита, и у 1/355 пациентов (<1%), получавших сорафениб. На протяжении всего лечения препаратом Инлита следует проводить мониторинг по появлению симптомов сердечной недостаточности. Лечение сердечной недостаточности может потребовать уменьшения дозы, прерывания или окончательного прекращения применения Инлита (см. «Способ применения и дозы»).
Перфорации пищеварительного тракта и образование фистулы
Во время клинических исследований были зарегистрированы перфорации пищеварительного тракта, в одном случае перфорация привела к летальному исходу. Также были получены сообщения о возникновении фистул.
В течение курса лечения Инлитом следует периодически контролировать состояние пациентов с целью выявления признаков перфорации пищеварительного тракта или образования фистулы.
Дисфункция щитовидной железы
Перед началом и периодически в течение курса лечения препаратом Инлита необходимо контролировать показатели функции щитовидной железы. Лечение гипо- и гипертиреоза, которое может возникнуть во время лечения, следует проводить в соответствии со стандартами медицинской помощи таким образом, чтобы поддерживать у пациента нормальное функционирование щитовидной железы.
Нарушение заживления ран
Нарушение заживления ран может наблюдаться у пациентов, которым применяют препараты, ингибирующие сигнальный путь сосудистого эндотелиального фактора роста (СЕФР). Поэтому Инлита может оказывать негативное влияние на заживление ран.
Лечение препаратом Инлита следует прекратить не менее чем за 2 дня до начала плановой операции. Не применять препарат в течение 2 недель после серьезной операции и до достаточного заживления раны. В зависимости от степени тяжести и стойкости нарушения заживления ран следует либо восстановить применение Инлита в уменьшенной дозе, либо окончательно прекратить такую терапию. Безопасность восстановления применения Инлита после преодоления осложнений заживления ран не установлена (см. раздел «Способ применения и дозы»).
Синдром задней обратной лейкоэнцефалопатии (СЗЗЛ)
СЗЗЛ является неврологическим расстройством, которое может проявляться в виде головных болей, судорожных приступов, сонливости, спутанности сознания, слепоты, расстройств зрения и других неврологических расстройств. Также может наблюдаться артериальная гипертензия любой степени (от легкой до тяжелой). Для подтверждения диагноза СЗЗЛ необходимо проведение МРТ. Пациентам, у которых возникает СЗЗЛ, необходимо окончательно отменить лечение препаратом Инлита. Безопасность восстановления лечения Инлитом для пациентов, ранее переносивших СЗЗЛ, неизвестна (см. раздел «Способ применения и дозы»).
Протеинурия
До начала и периодически в течение курса лечения Инлитом необходимо контролировать состояние пациентов для выявления протеинурии. Пациентам, у которых возникает протеинурия средней или тяжелой степени, необходимо временно приостановить применение Инлита, а затем уменьшить дозу (см. «Способ применения и дозы»).
Повышение активности ферментов печени
До начала и периодически в течение курса лечения препаратом Инлита необходимо контролировать уровни АЛТ, АСТ и билирубина.
Нарушение функций печени
В ходе специализированного исследования пациентов с нарушением функции печени уровни системной экспозиции после приема разовых доз препарата Инлита у больных с нарушением функции печени легкой степени (класс А по классификации Чайлда – Пью) не отличались от показателей у пациентов с нормальной функцией печени, а у пациентов с нарушением функции печени умеренной степени (класс В по классификации Чайлда – Пью) уровень системной экспозиции аксинтиниба был выше по сравнению с таким у пациентов, у которых функция печени была в норме. Если препарат Инлита назначен пациентам с умеренным нарушением функций печени (класс В по классификации Чайлда-Пью), рекомендуется снижать начальную дозу препарата. Применение препарата Инлита пациентам с нарушением функции печени тяжелой степени (класс С по классификации Чайлда-Пью) не исследовали (см. раздел «Способ применения и дозы» и «Фармакокинетика»).
Пациенты пожилого возраста и представители разных рас
В контролируемом клиническом исследовании применения препарата Инлита для лечения почечно-клеточной карциномы 34% пациентов в группе лечения препаратом Инлита были в возрасте от 65 лет. Большинство пациентов были представителями европеоидной расы (77%) или имели азиатское происхождение (21%). Хотя вероятность повышенной чувствительности к препарату у пациентов более старшего возраста и азиатов полностью исключить нельзя, в целом отличий в показателях безопасности и эффективности препарата Инлита между пациентами в возрасте ≥65 лет и младшими пациентами, а также между европеоидами и представителями других рас не было отмечено.
Изменение дозы в зависимости от возраста пациента и расы не требуется (см. раздел «Способ применения и дозы» и «Фармакокинетика»).
Лактоза
Это лекарственное средство содержит лактозу. Его не следует назначать пациентам с редкими наследственными нарушениями толерантности к галактозе, дефицитом лактазы Лаппа или синдромом нарушения всасывания глюкозы-галактозы.
Способность влиять на скорость реакции при управлении автотранспортом или работе с механизмами
Применение в период беременности или кормления грудью
Женщинам репродуктивного возраста следует сообщить о потенциальном риске для плода и необходимости использования эффективных средств контрацепции во время лечения препаратом Инлита и в течение одной недели после применения последней дозы. Мужчинам с партнерами репродуктивного возраста следует использовать эффективные средства контрацепции во время лечения Инлитом и в течение одной недели после применения последней дозы. Исследования на животных продемонстрировали, что Инлита может нарушать фертильность женщин и мужчин с репродуктивным потенциалом.
На сегодняшний день нет данных о присутствии акситиниба в грудном молоке человека или его влияния на младенца или на выработку молока. В связи с возможным возникновением серьезных нежелательных реакций у грудных детей под влиянием препарата Инлита, матерям рекомендовано прекратить кормление грудью во время лечения и в течение 2 недель после приема последней дозы.
Способ применения и дозы
При рвоте после приема дозы или при пропуске дозы не следует принимать дополнительную дозу препарата. Необходимо в должное время принять следующую плановую дозу.
Рекомендации по изменениям дозировки.
Повышение или понижение дозы проводят в зависимости от индивидуальных показателей безопасности и переносимости препарата.
Рекомендации по повышению или снижению дозы Инлита приведены в таблице 2.
Можно повышать дозу Инлиты пациентам, которые во время лечения нормально переносили препарат в течение по меньшей мере двух недель подряд, без побочных реакций второй и более высокой степени тяжести (согласно общим критериям оценки токсичности для нежелательных реакций), имеют нормальное артериальное давление и не применяют антигипертензивные препараты.
Таблица 2
Рекомендации по повышению или снижению дозы Инлита
Изменение дозы |
Схема применения |
| Рекомендуемая начальная доза | 5 мг дважды в день |
Увеличение дозы |
|
Первое увеличение дозы |
7 мг дважды в день |
Второе увеличение дозы |
10 мг дважды в день |
Уменьшение дозыа |
|
Первое уменьшение дозыб |
3 мг дважды в день |
Второе уменьшение дозы |
2 мг дважды в день |
а Для лечения побочных реакций на препарат б З 5 мг дважды в день. |
|
Рекомендации по изменению дозировки при побочных реакциях на препарат Инлита приведены в таблице 3.
Таблица 3
Рекомендации по изменению дозировки препарата Инлита при побочных реакциях
Побічна реакція |
Ступінь тяжкості |
Зміна дози препарату Інліта |
Артеріальна гіпертензія [див. «Особливості застосування»] |
Систолічний артеріальний тиск > 150 мм рт. ст. або діастолічний артеріальний тиск > 100 мм рт. ст., незважаючи на застосування гіпотензивних препаратів |
|
Систолічний артеріальний тиск > 160 мм рт. ст. або діастолічний артеріальний тиск > 105 мм рт. ст. |
|
|
Ступінь 4 або гіпертонічний криз |
|
|
Кровотеча [див. «Особливості застосування»] |
Ступінь 3 або 4 |
|
Серцева недостатність [див. «Особливості застосування»] |
Безсимптомна кардіоміопатія (фракція викиду лівого шлуночка більш ніж на 20 %, але менш ніж на 50 % нижча вихідного рівня або нижча нижньої межі норми, якщо вихідний рівень не вимірювали) |
|
Застійна серцева недостатність із клінічними проявами |
|
|
Порушення загоєння ран [див. «Особливості застосування»] |
Будь-який ступінь |
|
Синдром задньої зворотної лейкоенцефалопа-тії [див. «Особливості застосування»] |
Будь-який ступінь |
|
Протеїнурія [див. «Особливості застосування»] |
2 г білка в сечі або більше за 24 години |
|
Інші побічні реакції |
Ступінь 3 |
|
Ступінь 4 |
|
Изменения дозировки с учетом взаимодействия с другими лекарственными средствами
Мощные ингибиторы CYP3A4/5.
Следует избегать одновременного применения препарата с мощными ингибиторами CYP3A4/5 (такими как кетоконазол, итраконазол, кларитромицин, атазанавир, индинавир, нефазодон, нелфинавир, ритонавир, саквинавир, телитромицин и вориконазол). Для одновременного применения с препаратом Инлита рекомендуется подбирать альтернативный препарат с отсутствующим или минимальным потенциалом подавления активности CYP3A4/5. Возможности изменения дозирования препарата Инлита для пациентов, одновременно принимающих мощные ингибиторы CYP3A4/5, не исследовали. Но при необходимости одновременного назначения препарата Инлита и мощного ингибитора CYP3A4/5 рекомендуется снижать дозу препарата Инлита примерно вдвое, поскольку считается, что такое снижение позволяет вернуть значение AUC к диапазону значений, которые наблюдаются при применении препарата без ингибиторов. В дальнейшем возможно повышение или снижение дозы Инлита с учетом индивидуальных показателей безопасности и переносимости препарата. После окончания одновременного приема мощного ингибитора (через 3–5 периодов полувыведения ингибитора) дозу препарата Инлита следует снова повысить до уровня, назначенного до начала применения мощного ингибитора CYP3A4/5 (см. Взаимодействие с другими лекарственными средствами и другие виды взаимодействий) ).
Изменение дозировки при нарушении функций печени. При назначении препарата Инлита пациентам с нарушением функции печени легкой степени (класс А по классификации Чайлда – Пью) снижение начальной дозы препарата не требуется. На основании фармакокинетических данных начальную дозу препарата Инлита следует уменьшить примерно вдвое у пациентов с умеренной печеночной недостаточностью (класс B по шкале Чайлда-Пью) в начале лечения. В дальнейшем возможно повышение или снижение дозы Инлита, учитывая индивидуальные показатели безопасности и переносимости препарата. Применение препарата Инлита для лечения пациентов с нарушением функции печени тяжелой степени (класс С по классификации Чайлда-Пью) не исследовали (см. раздел «Особенности применения» и «Фармакокинетика у особых групп пациентов»).
Нарушение функции почек.
Специализированных исследований по применению аксинитина пациентам с нарушениями функций почек не проводили. Результаты популяционных анализов по фармакокинетике показали, что у пациентов с существующими нарушениями функции почек легкой, умеренной и тяжелой степени (клиренс креатинина от ≤15 мл/мин до <89 мл/мин) не было значительных отклонений показателей клиренса аксинитина (см. раздел «Фа ») Пациенты с существующим легким, умеренным или тяжелым нарушением функции почек не нуждаются в коррекции начальной дозы. Применять препарат для лечения пациентов с терминальной стадией почечной недостаточности (клиренс креатинина <15 мл/мин) следует с осторожностью.
Применение пациентам пожилого возраста
Больные пожилого возраста не нуждаются в коррекции дозы (см. разделы «Фармакокинетика» и «Особенности применения»).
Дети
Передозировка
В ходе контролируемого клинического исследования применения Инлита для лечения почечноклеточной карциномы один пациент непреднамеренно принимал препарат в дозе 20 мг дважды в день в течение 4 дней и испытывал при этом легкое головокружение.
В ходе клинического исследования, целью которого было определение дозы препарата Инлита, у участников, получавших препарат в начальных дозах 10 или 20 мг дважды в день, возникали побочные реакции, включавшие артериальную гипертензию, судороги, связанные с артериальной гипертензией, и кровохарканье. с летальным исходом.
Если есть подозрения в передозировке препаратом Инлита, прием препарата следует приостановить и начать симптоматическое лечение.
Побочные реакции
- артериальная гипертензия;
- артериальная тромбоэмболия;
- венозная тромбоэмболия
- кровотечение
- сердечная недостаточность
- перфорация пищеварительного тракта и образование фистул
- дисфункция щитовидной железы
- синдром задней обратной лейкоэнцефалопатии (СЗЗЛ)
- протеинурия
- повышение уровня печеночных ферментов
- нарушение функции печени
Безопасность применения Инлита оценивалась в ходе исследований режима монотерапии с участием 715 пациентов, из которых у 537 была распространена почечноклеточная карцинома. Приведенные в разделе «Побочные реакции» данные касаются применения Инлита 359 пациентам с распространенной почечноклеточной карциномой, которые участвовали в рандомизированном клиническом исследовании, где Инлита сравнивали с сорафенибом.
Опыт применения при клинических исследованиях.
Средняя продолжительность лечения составляла 6,4 месяца (диапазон от 0,03 до 22 месяцев) для пациентов, получавших Инлиту, и 5 месяцев (диапазон 0,03–20,1 месяца) для пациентов, получавших сорафениб. Модификации дозы или временное прекращение лечения из-за развития нежелательной реакции требовались 199 пациентам с 359 (55%), получавшим препарат Инлита, и 220 пациентам с 355 (62%), получавшим сорафениб. Из-за развития нежелательных реакций лечение было окончательно прекращено 34 пациентам с 359 (9%), получавшим препарат Инлита, и 46 пациентам с 355 (13%), получавшим сорафениб.
Наиболее распространенными (частота возникновения ≥20%) побочными реакциями, которые наблюдались при применении препарата Инлита, были: диарея, артериальная гипертензия, утомляемость, снижение аппетита, тошнота, дисфония, синдром ладонно-подошвенной эритродизестезии, снижение массы тела, рвота, а .
В таблице 4 отражены побочные реакции, зарегистрированные у ≥10% пациентов, получавших препарат Инлита или сорафениб.
Таблица 4
Побочные реакцииа |
Инлита |
Сорафениб |
||
(N=359) |
(N=355) |
|||
Все степениб |
Степень 3 или 4 |
Все степениб |
Степень 3 или 4 |
|
% |
% |
% |
% |
|
Диарея |
55 |
11 |
53 |
7 |
Артериальная гипертензия |
40 |
16 |
29 |
11 |
Утомляемость |
39 |
11 |
32 |
5 |
Снижение аппетита |
34 |
5 |
29 |
4 |
Тошнота |
32 |
3 |
22 |
1 |
Дисфония |
31 |
0 |
14 |
0 |
Синдром ладонно-подошовной эритродизестезии |
27 |
5 |
51 |
16 |
Снижение массы тела |
25 |
2 |
21 |
1 |
Рвота |
24 |
3 |
17 |
1 |
Астения |
21 |
5 |
14 |
3 |
Запор |
20 |
1 |
20 |
1 |
Гипотиреоз |
19 |
<1 |
8 |
0 |
Кашель |
15 |
1 |
17 |
1 |
Воспаление слизистой |
15 |
1 |
12 |
1 |
Артралгия |
15 |
2 |
11 |
1 |
Стоматит |
15 |
1 |
12 |
<1 |
Задышка |
15 |
3 |
12 |
3 |
Боль в животе |
14 |
2 |
11 |
1 |
Головная боль |
14 |
1 |
11 |
0 |
Боль в конечностях |
13 |
1 |
14 |
1 |
Высыпания |
13 |
<1 |
32 |
4 |
Протеинурия |
11 |
3 |
7 |
2 |
Дисгевзия |
11 |
0 |
8 |
0 |
Сухость кожи |
10 |
0 |
11 |
0 |
Диспепсия |
10 |
0 |
2 |
0 |
Зуд |
7 |
0 |
12 |
0 |
Алопеция |
4 |
0 |
32 |
0 |
Эритема |
2 |
0 |
10 |
<1 |
а Отражение в процентах всех категорий реакций, возникающих в ходе лечения. б Критерии обобщенной терминологии для побочных реакций Национального института рака 3.0. |
||||
Нижеследующие побочные реакции (всех степеней тяжести) у пациентов, получавших лечение препаратом Инлита, возникали с частотой <10%. Среди этих реакций были головокружение (9%), боли в верхней части живота (8%), миалгия (7%), дегидратация (6%), носовое кровотечение (6%), анемия (4%), геморрой (4%) , гематурия (3 %), звон в ушах (3 %), повышение уровней липазы (3 %), глосодиния (3 %), эмболия легочной артерии (2 %), кровотечение из прямой кишки (2 %), кровохарканье (2 %) ), тромбоз глубоких вен (1%), окклюзия/тромбоз вен сетчатки (1%), полицитемия (1%) и транзиторная ишемическая атака (1%).
В таблице 5 представлены наиболее распространенные отклонения показателей лабораторных анализов, зарегистрированные у ≥10% пациентов, получавших препарат Инлита или сорафениб.
Таблица 5
Відхилення лабораторного показника |
N |
Інліта |
N |
Сорафеніб |
||
Всі ступеніа |
Ступінь 3 або 4 |
Всі ступеніа |
Ступінь 3 або 4 |
|||
% |
% |
% |
% |
|||
Клинические показатели крови |
||||||
Снижение уровня гемоглобина |
320 |
35 |
<1 |
316 |
52 |
4 |
Снижение (абсолютного) числа лимфоцитов |
317 |
33 |
3 |
309 |
36 |
4 |
Снижение количества тромбоцитов |
312 |
15 |
<1 |
310 |
14 |
0 |
Снижение количества лейкоцитов |
320 |
11 |
0 |
315 |
16 |
<1 |
Биохимические показатели крови |
||||||
Повышение уровня креатинина |
336 |
55 |
0 |
318 |
41 |
<1 |
Снижение уровня бикарбоната |
314 |
44 |
<1 |
291 |
43 |
0 |
Гипокальциемия |
336 |
39 |
1 |
319 |
59 |
2 |
Повышение уровня ЛФ |
336 |
30 |
1 |
319 |
34 |
1 |
Гипергликемия |
336 |
28 |
2 |
319 |
23 |
2 |
Повышение уровня липазы |
338 |
27 |
5 |
319 |
46 |
15 |
Повышение активности амилазы |
338 |
25 |
2 |
319 |
33 |
2 |
Повышение уровня АЛТ |
331 |
22 |
<1 |
313 |
22 |
2 |
Повышение уровня АСТ |
331 |
20 |
<1 |
311 |
25 |
1 |
Гипернатриемия |
338 |
17 |
1 |
319 |
13 |
1 |
Гипоальбуминемия |
337 |
15 |
<1 |
319 |
18 |
1 |
Гиперкалиемия |
333 |
15 |
3 |
314 |
10 |
3 |
Гипогликемия |
336 |
11 |
<1 |
319 |
8 |
<1 |
Гипонатриемия |
338 |
13 |
4 |
319 |
11 |
2 |
Гипофосфатемия |
336 |
13 |
2 |
318 |
49 |
16 |
а Критерии обобщенной терминологии для побочных реакций Национального института рака, версии 3.0:
ЛФ – щелочная фосфатаза; АЛТ – аланинаминотрансфераза; АСТ – аспартотаминотрансфераза.
Изменения отдельных лабораторных показателей (всех степеней выраженности) наблюдались у < 10% пациентов, получавших препарат Инлита, в том числе повышение уровня гемоглобина выше верхнего предела нормы (9% в группе препарата Инлита по сравнению с 1% в группе сорафениба) и гиперкальциемия (6 % в группе препарата Инлита по сравнению с 2 % в группе сорафениба).
Пострегистрационный опыт
Указанные ниже побочные реакции были зарегистрированы в послерегистрационном опыте применения Инлита. Поскольку эти сообщения поступали добровольно от популяции неопределенного размера, невозможно оценить их частоту или установить причинно-следственную связь с экспозицией препарата.
Со стороны сосудов: артериальные (включая аортальные) аневризмы, диссекции и разрывы.
Срок годности
Условия хранения
Упаковка
Категория отпуска
Производитель
Местонахождение производителя и его адрес места осуществления деятельности
Источник инструкции
Обратите внимание!
Описание лекарственного средства на этой странице носит исключительно информационный характер. Для того чтобы правильно выбрать препарат для лечения вашего заболевания, обращайтесь к врачу.
Самолечение может повредить вашему здоровью!
ᐉ Онлайн-аптека Подорожник • Заказ лекарств онлайн с доставкой • Сеть аптек по всей Украине не несет ответственности за некорректное использование информации, размещенной на сайте, и возможные негативные последствия этого. Детальнее отказ от ответственности.