
- Основное
- Наличие в аптеках
- Инструкция
- Написать отзыв
Бемфола раствор для инъекций по 300 МЕ/0,5 мл, 1 шт.
Получите AI аналитику по товару Бемфола раствор для инъекций по 300 МЕ/0,5 мл, 1 шт.:

Аллергикам | |
Водителям | |
Беременным | |
Кормящим матерям | |
Детям | |
Температура хранения | |
Рецептурный отпуск |
Свойства препарата Бемфола раствор для инъекций по 300 МЕ/0,5 мл, 1 шт.
Основные
| Действующее вещество | |
| Торговое название | |
| Категория | |
| GTIN | 5997001367391 |
| Страна производитель | Венгрия |
| Температура хранения | от 2 °С до 8 °С |
| Срок годности | 3 года |
| Рецептурный отпуск | по рецепту |
| Кол-во в упаковке | 1 |
| Код Морион | 519737 |
| Объем | 0,5 мл |
| Первичная упаковка | Картридж |
| Упаковка | По 0,50 мл раствора в 1 предварительно наполненной ручке с одноразовой иглой в картонной коробке |
| Способ введения | подкожно |
| Производитель |
Кому можна
| Аллергикам | с осторожностью |
| Водителям | разрешено |
| Беременным | запрещено |
| Кормящим матерям | запрещено |
| Детям | запрещено |
Перед публикацией Ваш отзыв может быть отредактирован для исправления грамматики, орфографии или удаления неприемлемых слов и контента. Отзывы, которые, как нам кажется, созданы заинтересованными сторонами, не будут опубликованы. Старайтесь рассказывать о собственном опыте, избегая обобщений.
Бемфола раствор для инъекций по 300 МЕ/0,5 мл, 1 шт. - Инструкция по применению
Состав
1 мл раствора содержит 600 МЕ (44 мкг) фолитропина альфа;
одна предварительно наполненная ручка содержит: 300 МЕ (22 мкг) фолитропина альфа в 0,5 мл;
*рекомбинантный человеческий фолликулостимулирующий гормон (р-лФСГ)
другие составляющие: сахароза; натрия гидрофосфат, дигидрат; натрия дигидрофосфат, дигидрат; L-метионин; полоксамер 188/ лютрол F-68; кислота фосфорная; вода для инъекций.
Лекарственная форма
Основные физико-химические свойства: бесцветный прозрачный раствор.
Фармакотерапевтическая группа
Фармакодинамика
Бемфола – это подобное биологическое лекарственное средство, действующим веществом которого является рекомбинантный человеческий фолликулостимулирующий гормон (р-лФСГ), полученный методом генной инженерии из клеток яичника китайского хомячка.
Механизм действия
Фолликулостимулирующий гормон (ФСГ) и лютеинизирующий гормон (ЛГ) секретируются передней долей гипофиза в ответ на гонатропин-рилизинг-гормон (ГнРГ) и играют дополнительную роль в развитии фолликула и овуляции. ФСГ стимулирует развитие фолликулов яичников, тогда как ЛГ участвует в развитии фолликулов, стероидогенезе и созревании.
Фармакодинамические эффекты
Уровни ингибина и эстрадиола (Е2) повышаются после введения р-лФСГ с последующей индукцией развития фолликулов. Повышение уровня ингибина в сыворотке происходит быстро и может наблюдаться уже на третий день применения р-лФСГ, тогда как для повышения уровня E2 требуется больше времени – такое повышение наблюдается только с четвертого дня лечения. Общий объем фолликулов начинает увеличиваться через 4–5 дней ежедневного применения р-лФСГ и, в зависимости от ответа пациента, максимальный эффект достигается через 10 дней от начала введения р-лФСГ.
Клиническая эффективность и безопасность применения для женщин
В клинических исследованиях пациентки с тяжелой недостаточностью ФСГ и лютеинизирующего гормона (ЛГ) определялись по сывороточному уровню эндогенного ЛГ <1,2 МЕ/л, полученному при анализе в центральной лаборатории. Однако следует учесть, что уровень ЛГ, определенный в разных лабораториях, может отличаться.
В клинических исследованиях с целью сравнения рекомбинантного человеческого ФСГ (р-лФСГ) (фолитропина альфа) и мочевого ФСГ при проведении процедур вспомогательных репродуктивных технологий (ВРТ) (см. таблицу 1) и индукции овуляции фолитропин альфа оказался эффективнее мочевого в низшей общей дозе и более коротком периоде лечения, необходимых для индукции созревания фолликула. Применение низших доз фолитропина альфа в течение более короткого периода лечения при проведении ВРТ позволило получить большее количество яйцеклеток, чем при применении мочевого ФСГ.
Таблица 1
Результаты исследования GF 8407 (рандомизированное исследование в параллельных группах с целью сравнения эффективности и безопасности фолитропина альфа и мочевого ФСГ в случае применения вспомогательных репродуктивных технологий)
|
|
Фолитропин альфа (n = 130) |
Мочевой ФСГ (n = 116) |
|
Количество полученных яйцеклеток
|
11,0 ± 5,9 |
8,8 ± 4,8 |
|
Необходимое количество дней стимуляции при применении ФСГ |
11,7 ± 1,9 |
14,5 ± 3,3 |
|
Необходима общая доза ФСГ (количество ампул ФСГ по 75 МЕ) |
27,6 ± 10,2 |
40,7 ± 13,6 |
|
Необходимость увеличения дозы (%) |
56,2 |
85,3 |
Разница между двумя группами была статистически значимой (p<0,05) по всем перечисленным критериям.
Клиническая эффективность и безопасность применения для мужчин
У мужчин с недостаточностью ФСГ одновременное применение фолитропина альфа и лХГ в течение не менее 4 месяцев способствует индуцированию сперматогенеза.
Фармакокинетика
Распределение
После введения фолитропин альфа распределяется в межклеточной жидкости с начальным периодом полувыведения, что составляет примерно 2 часа, и выводится из организма с конечным периодом полувыведения, составляющего от 14 до 17 часов. Равновесный объем распределения составляет от 9 до 11 л.
После подкожного введения абсолютная биодоступность фолитропина альфа составляет 66%, а очевидный конечный период полувыведения – в пределах от 24 до 59 часов. Дозовая пропорциональность после подкожного введения была продемонстрирована до 900 МЕ. Повторное введение фолитропина альфа приводит к увеличению его кумуляции в три раза с достижением равновесного состояния в течение 3–4 дней.
Вывод
Общий клиренс составляет 0,6 л/ч и около 12% дозы фолитропина альфа выводится с мочой.
Показания
- Ановуляция (включая синдром поликистозных яичников (СПКЯ)) у женщин, оказавшихся нечувствительными к лечению кломифена цитратом.
- Стимуляция развития множественных фолликулов у пациенток при проведении суперовуляции в рамках вспомогательных репродуктивных технологий (ВРТ), таких как экстракорпоральное оплодотворение (ЭКО), перенос гаметы в фаллопиевую трубу и перенос зиготы в фаллопиевую трубу.
- Фолитропин альфа в сочетании с препаратами лютеинизирующего гормона (ЛГ) показан для стимуляции развития фолликулов у женщин с тяжелой недостаточностью ЛГ и ФСГ.
- Фолитропин альфа предназначен для стимуляции сперматогенеза у мужчин с врожденным или приобретенным гипогонадотропным гипогонадизмом одновременно с терапией человеческим хорионическим гонадотропином (лХГ).
Противопоказания
- Гиперчувствительность к действующему веществу или любому из вспомогательных веществ (см. раздел «Состав»);
- опухоли гипоталамуса или гипофиза;
- увеличение размера яичников или кисты яичников, не связанных с синдромом поликистозных яичников и неизвестного происхождения;
- гинекологические кровотечения неизвестного происхождения;
- рак яичников, матки или молочных желез.
- первичной недостаточности яичников;
- пороках половых органов, несовместимых с беременностью;
- фиброзных опухолях матки, несовместимых с беременностью;
- первичной тестикулярной недостаточности
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Особенности применения
С целью улучшения отслеживания биологических лекарственных средств и сообщения о подозреваемых побочных реакциях медицинским работникам следует четко записать торговое название и номер партии введенного препарата в медицинскую карту пациента.
Общие рекомендации
Поскольку фолитропин альфа проявляет значительную гонадотропную активность, способную вызвать развитие побочных реакций от легкой до тяжелой степени, препарат могут назначать только врачи, хорошо знакомые с проблемами бесплодия и методами его лечения.
Терапия гонадотропинами требует затрат времени от врачей и других медицинских работников, а также наличия соответствующей аппаратуры для мониторинга лечения. Безопасное и эффективное применение фолитропина альфа для женщин предусматривает регулярный мониторинг овариальной реакции с помощью ультразвукового исследования, отдельно или преимущественно в сочетании с одновременным регулярным определением сывороточного уровня эстрадиола. Возможна определенная индивидуальная вариабельность ответа на применение ФСГ, то есть у одних пациентов может отмечаться слабая реакция на ФСГ, а у других – чрезмерная. Для лечения как женщин, так и мужчин следует применять низкую эффективную дозу препарата в соответствии с целью лечения.
Порфирия
Во время лечения фолитропином альфа пациенты с порфирией или случаями порфирии в семейном анамнезе должны находиться под тщательным контролем. При первых признаках развития этого состояния или его ухудшении может возникнуть потребность в прекращении лечения.
Лечение женщин
Перед началом лечения необходимо исследовать бесплодие пара и определить возможные противопоказания к беременности. В частности, пациентов следует обследовать наличие гипотиреоза, недостаточности надпочечников, гиперпролактинемии и назначить им соответствующее специфическое лечение.
При проведении стимуляции роста фолликулов при лечении ановуляторного бесплодия или процедур ВРТ у пациенток может наблюдаться увеличение размера яичников или развитие гиперстимуляции. Соблюдение рекомендуемой дозировки и режима введения фолитропина альфа, а также тщательный мониторинг терапии снизят частоту подобных явлений. Точная интерпретация показателей развития фолликулов и созревания требует привлечения специалиста, имеющего опыт толкования соответствующих тестов.
В ходе клинических исследований было выявлено усиление чувствительности яичников к действию фолитропина альфа при одновременном введении лютропина альфа. Если считается необходимым увеличение дозы ФСГ, корректировку дозы желательно осуществлять с интервалами в 7–14 дней и с пошаговым повышением на 37,5–75 МЕ.
Прямого сравнения применения фолитропина альфа/ЛГ и человеческого менопаузального гонадотропина (лМГ) не проводилось. Сравнение с имеющимися данными позволяет предположить, что частота овуляций, полученная при применении фолитропина альфа/ЛГ, подобна частоте, полученной для лМГ.
Синдром гиперстимуляции яичников (СГСЯ)
Ожидаемым следствием контролируемой стимуляции яичников является определенное увеличение. Это явление, наиболее распространенное у женщин с синдромом поликистозных яичников, обычно проходит без лечения.
В отличие от неосложненного увеличения размера яичников СГСЯ является синдромом, проявляющимся с нарастанием степени тяжести. Он включает в себя значительное увеличение размера яичников, высокие сывороточные уровни половых стероидов и рост проницаемости сосудов, что может привести к накоплению жидкости в брюшной, плевральной и иногда в перикардиальной полостях.
В тяжелых случаях СГСЯ могут наблюдаться следующие симптомы: боль и растяжение в брюшной полости, значительное увеличение размера яичников, увеличение массы тела, одышка, олигурия и симптомы со стороны желудочно-кишечного тракта, включая тошноту, рвоту и диарею. При клиническом обследовании могут быть обнаружены гиповолемия, гемоконцентрация, электролитный дисбаланс, асцит, гемоперитонеум, плевральные выпоты, гидроторакс или острый респираторный дистресс-синдром. В редких случаях тяжелый СГСЯ может быть осложнен извращением яичников и тромбоэмболическими явлениями, такими как эмболия легочной артерии, ишемический инсульт и инфаркт миокарда.
К независимым факторам риска развития СГСЯ относятся молодой возраст пациента, безжировая масса тела, синдром поликистозных яичников, повышенные дозы экзогенных гонадотропинов, высокие абсолютные или быстро растущие сывороточные уровни эстрадиола и предшествующие эпизоды СГСЯ, большое количество. полученных в циклах вспомогательных репродуктивных технологий (ВРТ).
Соблюдение рекомендуемой дозировки и режима введения фолитропина альфа может минимизировать риск овариальной гиперстимуляции (см. раздел «Способ применения и дозы» и «Побочные реакции»). Для раннего выявления соответствующих факторов риска рекомендуется проводить мониторинг циклов стимуляции с помощью ультразвукового исследования и определения уровня эстрадиола.
Известно, что лХГ играет ключевую роль в инициации СГСЯ и что этот синдром может становиться более тяжелым и длительным при наступлении беременности. Это му при наличии признаков гиперстимуляции яичников, таких как сывороточные уровни эстрадиола >5500 пг/мл, или >20200 пмоль/л, и/или общее количество фолликулов ≥40, рекомендуется отменить введение лХГ и посоветовать пациентке воздерживаться от половых заболеваний. средства контрацепции на протяжении не менее 4 дней. СХСЯ может быстро прогрессировать (в пределах 24 часов) и в течение нескольких дней стать серьезным медицинским осложнением. Чаще он возникает после прекращения гормональной терапии и достигает максимума примерно через 7–10 дней после завершения лечения. Поэтому после введения лХГ пациентки должны находиться под контролем не менее 2 недель.
Частоту развития гиперстимуляции при проведении ВРТ может уменьшить аспирация всех фолликулов к овуляции.
Обычно легкие или умеренные формы СГСЯ проходят спонтанно. В случае тяжелой формы СГСЯ лечение гонадотропинами рекомендуется прекратить, если оно продолжается, пациентку следует госпитализировать и начать соответствующую терапию.
Многоплодная беременность
Частота многоплодных беременностей при индукции овуляции выше, чем после естественного оплодотворения. Большинство множественных оплодотворений представлено двойнями. Многоплодная беременность, особенно высшего порядка, несет повышенный риск нежелательных последствий матери, плода и новорожденного.
Для понижения риска многоплодной беременности рекомендуется тщательно контролировать реакцию яичников.
При проведении процедур ВРТ риск многоплодной беременности связан главным образом с количеством пересаженных эмбрионов, их качеством и возрастом пациентки.
Пациентки должны быть уведомлены о потенциальном риске многоплодной беременности до начала лечения.
Прерывание беременности
У пациенток при проведении стимуляции роста фолликулов для индукции овуляции или ВРТ частота случаев прерывания беременности вследствие выкидыша или спонтанного аборта выше, чем после естественного оплодотворения.
Внематочная беременность
Женщины с заболеваниями труб в анамнезе имеют риск внематочной беременности независимо от того, наступила ли она вследствие спонтанного оплодотворения или лечения бесплодия. Сообщалось, что распространенность внематочной беременности после проведения ВРТ выше, чем в общей популяции.
Новообразование органов репродуктивной системы
Существуют сообщения как о доброкачественных, так и о злокачественных новообразованиях яичников и других органов репродуктивной системы у женщин, проходивших различные режимы лечения бесплодия. Пока не установлено, увеличивает ли лечение гонадотропинами риск развития таких опухолей у бесплодных женщин.
Врожденные пороки
Распространенность врожденных пороков после проведения ВРТ может быть несколько выше, чем после спонтанного оплодотворения. Считается, что это следствие характеристик состояния здоровья родителей (например, возраст матери, свойства спермы отца) и многоплодных беременностей.
Тромбоэмболические осложнения
У женщин с недавними или существующими тромбоэмболическими заболеваниями и у женщин, для которых установлены факторы риска развития тромбоэмболических явлений, такие как индивидуальные или семейные случаи, лечение гонадотропинами может привести к дальнейшему росту риска обострения или появлению подобных явлений. У таких женщин необходимо оценить преимущество применения гонадотропинов существующему риску развития таких осложнений. Однако следует отметить, что беременность и СГСЯ увеличивают риск развития тромбоэмболических осложнений.
Лечение мужчин
Увеличение эндогенных уровней ФСГ у пациентов является показателем первичной тестикулярной недостаточности.Такие пациенты нечувствительны к терапии фолитропином альфа/лХГ. Фолитропин альфа не следует применять в случаях, когда невозможно получить эффективный ответ на лечение.
Для оценки реакции на лечение рекомендуется проводить анализ семенной жидкости через 4–6 месяцев после начала лечения.
Содержание натрия
Лекарственное средство содержит менее 1 ммоль натрия (23 мг) в одной дозе, то есть практически не содержит натрия.
Способность влиять на скорость реакции при управлении автотранспортом или работе с механизмами
Применение в период беременности или кормления грудью
Показания к применению фолитропина альфа в период беременности нет. Данные относительно небольшого количества случаев применения препарата в период беременности (менее 300 случаев) свидетельствуют об отсутствии развития врожденных пороков у плода и проявлений фето/неонатальной токсичности фолитропина альфа.
В исследованиях на животных тератогенного эффекта не наблюдалось. Клинических данных для исключения тератогенного эффекта фолитропина альфа при его применении во время беременности недостаточно.
Кормление грудью
Фолитропин альфа не показан для применения в период кормления грудью.
Фертильность
Фолитропин альфа показан для лечения бесплодия (см. раздел «Показания»).
Способ применения и дозы
Первую инъекцию лекарственного средства следует проводить под непосредственным наблюдением медицинского работника. Самостоятельное введение лекарственного средства могут проводить только хорошо мотивированные, должным образом обученные пациенты, которые в случае необходимости могут проконсультироваться со специалистом. Место инъекции следует менять каждый день.
Предварительно наполненная ручка, содержащая картридж с разовой дозой лекарственного средства Бемфола, предназначена для одноразового применения. Следовательно, пациенты должны получить четкие инструкции, чтобы не допустить неправильного применения одноразового устройства.
РЕКОМЕНДАЦИИ ДЛЯ САМОСТОЯТЕЛЬНОГО ВВЕДЕНИЯ ЛЕКАРСТВЕННОГО СРЕДСТВА БЕМФОЛА С ПОМОЩЬЮ ГОТОВОЙ К ПРИМЕНЕНИЮ РУЧКИ ДЛЯ ВВЕДЕНИЯ
Предупреждение: Пожалуйста, внимательно прочтите инструкцию перед самостоятельным применением ручки для введения с препаратом Бемфола. Не следуйте указаниям из других источников, кроме тех, которые приведены в данной инструкции по медицинскому применению, или указаниям врача, поскольку это может поставить под угрозу правильное использование предварительно наполненной ручки и ваше лечение.
1. Как пользоваться предварительно наполненной ручкой с препаратом Бемфола
- Полностью прочтите инструкцию перед применением предварительно наполненной ручки.
- Каждая предварительно наполненная ручка предназначена только для вашего использования, не позволяйте другим людям пользоваться ею.
- Цифры на дисплее предварительно заполненной ручки означают дозу препарата в международных единицах (МЕ).Врач скажет Вам, сколько МО Вам необходимо вводить каждый день.
- Ваш врач/фармацевт расскажет Вам, сколько предварительно наполненных ручек для введения с препаратом Бемфола Вам необходимо будет использовать в течение полного курса лечения.
- Делайте себе инъекцию каждый день в то же время.
2.1. Достаньте ручку из холодильника
- Извлеките одну из ваших ручек для ввода из холодильника за 5–10 минут до ее использования.
- Если препарат заморожен, не используйте его.
- Вымойте руки теплой водой с мылом и высушите их.
- Важно, чтобы Ваши руки и все, что Вы будете использовать при подготовке ручки для ввода, были как можно более чистыми.
- Подходящим местом может быть чистый стол или другая поверхность.
Различные части предварительно наполненной ручки
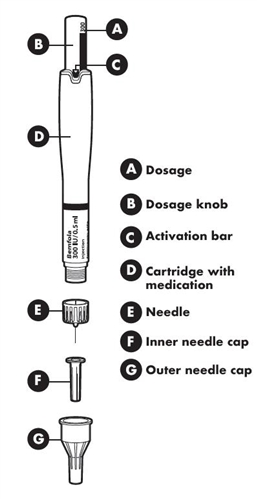 |
A – дозатор; B – регулятор дозы; C – лента активации; D – Картридж с лекарственным средством; E – игла; F –¦внутренний колпачок иглы; G – внешний колпачок иглы |
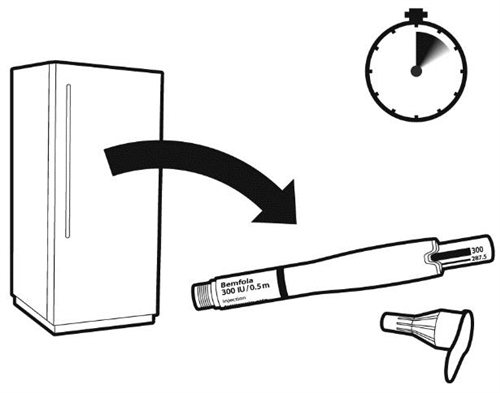 |
Делайте инъекцию каждый день примерно в то же время. Извлеките ручку для ввода из холодильника за 5–10 минут до ее применения. Примечание: Убедитесь, что препарат не заморожен. |
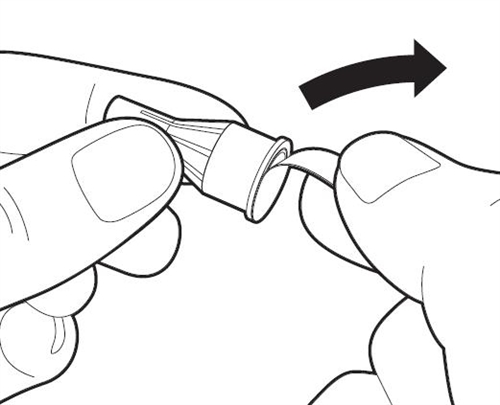 |
Подготовьте иглу для инъекции Достаньте новую иглу. Используйте только одноразовые иглы, входящие в комплект упаковки. Крепко держите наружный колпачок иглы. Во всех случаях проверяйте, чтобы этикетка контроля раскрывания не была повреждена или ослаблена. Снимите с иглы для инъекций этикетку контроля раскрывания. Внимание: Если этикетка контроля раскрывания повреждена или ослаблена, не используйте иглу. Выбросите ее в контейнер для утилизации острых предметов. Возьмите новую иглу. |
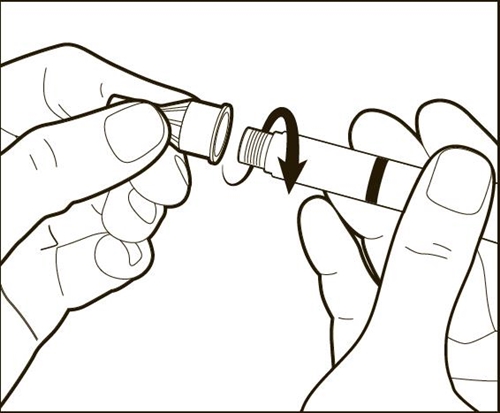 |
Прикрепите иглу. Держите ручку по бокам и иглу на одной линии с ручкой, накрутите иглу по часовой стрелке на кончик ручки до конца, пока она крепко не закрепится. Убедитесь, что игла правильно закреплена на ручке в прямом положении. Внимание: не затягивайте иглу слишком сильно. Не нажимайте на регулятор дозы при подключении иглы. |
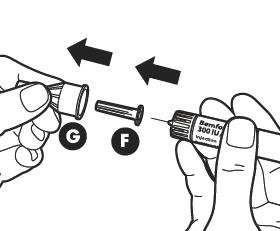 |
Снимите внешний колпачок иглы (G).Храните колпачок – он потребуется после инъекции, чтобы выбросить ручку. Снимите внутренний колпачок иглы (F). Убедитесь, что игла находится в правильном положении. |
Правильное положение иглы 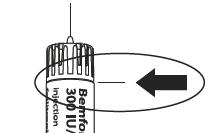 |
Неправильное положение иглы 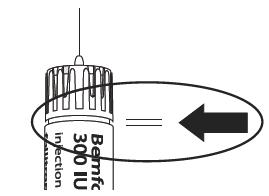 |
4. Установка дозы, которая назначена врачом |
|
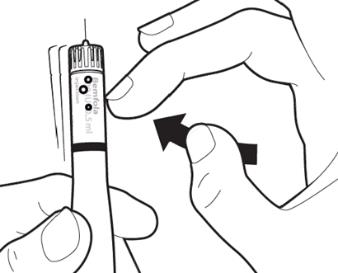 |
Сначала держите ручку для ввода иглой вверх. Чтобы удалить воздушные пузырьки из системы, легко постучите по боковой поверхности ручки, чтобы возможные воздушные пузырьки поднялись вверх. |
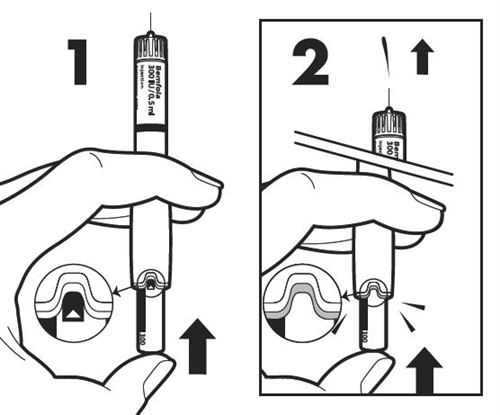 |
Держите ручку для ввода иглой вверх, нажмите регулятор дозы, пока не исчезнет лента активации с маленькой стрелкой. Вы также услышите щелчок и небольшое количество жидкости высвободится из иглы (это нормально). Теперь ручка готова к установке дозы. Внимание: Если жидкость не выпрыснет или на стыке иглы и ручки обнаружится утечка жидкости, ручку для ввода применять нельзя. Сообщите врачу или фармацевту, если вы заметили какие-либо проблемы. |
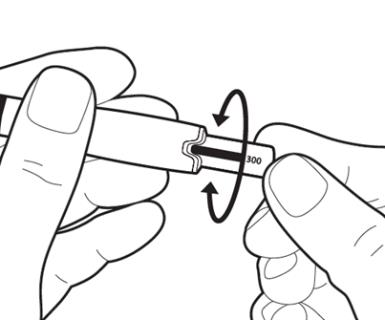 |
Осторожно поворачивайте регулятор дозы, пока показатель назначенной дозы не появится на одной линии с серединой выступа на ручке. Примечание: В предварительно наполненной ручке с дозировкой 75 МЕ/0,125 мл регулятор дозы нельзя вернуть полностью, но его можно возвращать в обратном направлении. Теперь ручка для ввода готова к инъекции. Внимание: не нажимайте на регулятор дозы в данный момент. |
5. Введение дозы Теперь Вы готовы к немедленному введению инъекции. Ваш врач или медсестра уже посоветовали Вам, в какой участок тела делать инъекцию (например, живот, передняя поверхность бедра). Чтобы минимизировать раздражение кожи, каждый день выбирайте другое место для инъекции. |
|
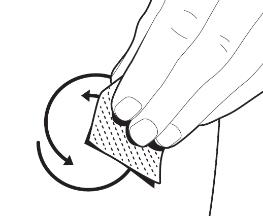 |
Круговыми движениями протрите кожу в месте инъекции салфеткой, пропитанной спиртом, которая находится в упаковке. Подождите несколько секунд, пока спирт не улетучится из кожи и она подсохнет, прежде чем делать инъекцию. |
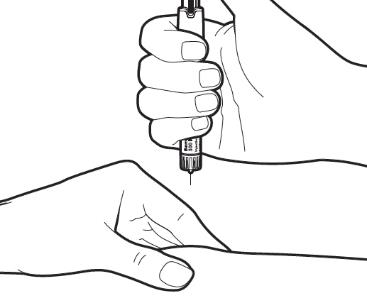 |
Убедитесь, что правильная доза отображается на ручке. Осторожно соберите в складку кожу участка инъекции. Внимание: Не нажимайте на регулятор дозы при введении иглы и не изменяйте направление иглы при введении в кожу. |
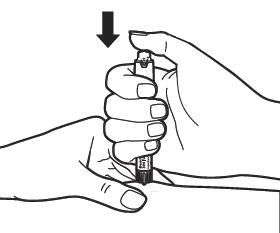 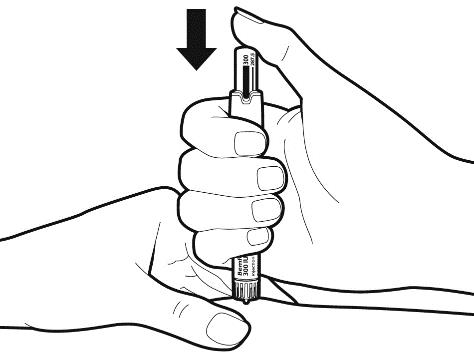 |
После того, как игла полностью введена в место инъекции, нажимайте регулятор дозы медленно и непрерывно до упора, пока индикатор установленной дозы не исчезнет. Не извлекайте иглу сразу, подождите по крайней мере 5 секунд, прежде чем вытащить ее, чтобы убедиться, что вы ввели полную дозу. Вытащив иглу, круговыми движениями протрите кожу спиртовой салфеткой. Внимание: Если во время инъекции на стыке иглы и ручки обнаружена утечка жидкости, сообщите об этом врачу или фармацевту. |
6. После инъекции |
|
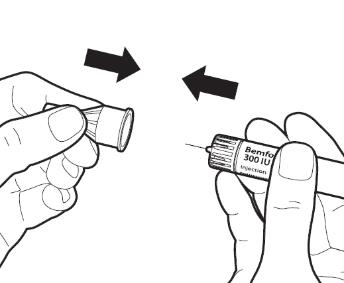 |
Осторожно наденьте на иглу наружный колпачок. |
 |
Предварительно наполненную ручку можно использовать только один раз. Ее нужно выбросить, даже если после инъекции в ручке осталась жидкость. Выбросьте в мусорник упаковку, внутренний колпачок иглы, наклейку, спиртовую салфетку и Инструкцию по медицинскому применению. Не выбрасывайте лекарственные средства в раковину, туалет или бытовую свалку. Использованную ручку необходимо поместить в контейнер для острых предметов и вернуть в медицинское учреждение для правильной утилизации. Спросите у своего фармацевта, как распоряжаться лекарственным средством, которым Вы больше не пользуетесь. |
| Примечание: В течение срока годности закрытое лекарственное средство может храниться при температуре не выше 25 ºС в течение 3 месяцев без повторного охлаждения; лекарственное средство следует утилизировать, если оно не было использовано по истечении 3 месяцев. | |
Дети
Передозировка
Побочные реакции
Наиболее распространенными побочными реакциями являются головная боль, кисты яичников и реакции в месте введения (например, боль, эритема, гематома, отек и/или раздражение в месте инъекции).
Часто сообщалось о случаях синдрома гиперстимуляции яичников (СГСЯ) легкой или умеренной степени тяжести, которую следует считать неотъемлемым риском процедуры стимуляции. Тяжелые формы СГСЯ редки (см. раздел «Особенности применения»).
Очень редко возможны случаи тромбоэмболии (см. «Особенности применения»).
Для определения частоты побочных реакций используют следующие критерии:
Очень частые (≥1/10, возникают более чем у 1 из 10 человек).
Частые (от ≥1/100 до <1/10, возникают не более чем у 1 из 10 человек).
Нечастые (от ≥1/1000 до <1/100, возникают не более чем у 1 из 100 человек).
Одиночные (от ≥1/10000 до <1/1000, возникают не более чем у 1 из 1000 человек).
Редкие (<1/10000, возникают менее чем у 1 из 10000 человек).
Лечение женщин
Со стороны иммунной системы
Редкие реакции гиперчувствительности от легкой до тяжелой степени, включая анафилактические реакции и шок.
Со стороны нервной системы
Очень частые: головные боли.
Сосудистые расстройства
Редкие: тромбоэмболия (как в сочетании с СГСЯ, так и отдельно).
Со стороны дыхательной системы, органов грудной клетки и средостения.
Редкие: обострение или ухудшение астмы.
Со стороны пищеварительной системы
Часто: боль в животе, ощущение растяжения и дискомфорта в брюшной полости, тошнота, рвота, диарея.
Со стороны репродуктивной системы и молочных желез
Очень частые: кисты яичников.
Часто: СГСЯ от легкой до умеренной степени тяжести (включая сопутствующие симптомы).
Нечасто: тяжелый СГСЯ (включая сопутствующие симптомы) (см. раздел «Особенности применения»).
Единичные: осложнение тяжелого СХСЯ.
Общие расстройства и реакции в месте введения
Очень часто: реакции в месте инъекции (например, боль, эритема, гематома, отек и/или раздражение в месте инъекции).
Лечение мужчин
Со стороны иммунной системы
Редкие реакции гиперчувствительности от легкой до тяжелой степени, включая анафилактические реакции и шок.
Со стороны дыхательной системы, органов грудной клетки и средостения.
Редкие: обострение или ухудшение астмы.
Со стороны кожи и подкожных тканей.
Части: акне.
Со стороны репродуктивной системы и молочных желез
Часто: гинекомастия, варикоцеле.
Общие расстройства и реакции в месте введения
Очень часто: реакции в месте инъекции (например, боль, эритема, гематома, отек и/или раздражение в месте инъекции).
Лабораторные и инструментальные данные
Часто: увеличение массы тела.
Сообщения о подозреваемых побочных реакциях
Сообщение о побочных реакциях после регистрации лекарственного средства имеет важное значение. Это позволяет проводить мониторинг соотношения польза/риск при применении этого лекарственного средства. Медицинским и фармацевтическим работникам, а также пациентам или их законным представителям следует сообщать о всех случаях подозреваемых побочных реакций и отсутствии эффективности лекарственного средства через Автоматизированную информационную систему по фармаконадзора по ссылке: https://aisf.dec.gov.ua.
Медицинским работникам следует убедиться, что торговое название и номер серии лекарственного средства указаны в сообщении о подозреваемой побочной реакции.
Срок годности
После вскрытия лекарственное средство следует вводить немедленно.
Не применять по истечении срока годности, указанного на упаковке.
Условия хранения
До открытия в течение срока годности закрытое лекарственное средство может храниться в холодильнике при температуре не выше 25 ºС в течение 3 месяцев без повторного охлаждения. Лекарственное средство следует утилизировать, если оно не было использовано в течение 3 месяцев.
Хранить в оригинальной упаковке для защиты от света.
Хранить в недоступном для детей месте.
Упаковка
Категория отпуска
Производитель
Местонахождение производителя и его адрес места осуществления деятельности
Источник инструкции
Обратите внимание!
Описание лекарственного средства на этой странице носит исключительно информационный характер. Для того чтобы правильно выбрать препарат для лечения вашего заболевания, обращайтесь к врачу.
Самолечение может повредить вашему здоровью!
ᐉ Онлайн-аптека Подорожник • Заказ лекарств онлайн с доставкой • Сеть аптек по всей Украине не несет ответственности за некорректное использование информации, размещенной на сайте, и возможные негативные последствия этого. Детальнее отказ от ответственности.

