- Основное
- Наличие в аптеках
- Инструкция
- Аналоги 1
- Написать отзыв
Альминда таблетки по 90 мг, 56 шт.
Получите AI аналитику по товару Альминда таблетки по 90 мг, 56 шт.:
Аллергикам | |
Водителям | |
Беременным | |
Кормящим матерям | |
Детям | |
Температура хранения | |
Рецептурный отпуск |
Свойства препарата Альминда таблетки по 90 мг, 56 шт.
Основные
| Действующее вещество | |
| Торговое название | Альминда |
| Категория | |
| GTIN | 5000456076272 |
| Страна производитель | Швеция |
| Импортный | Да |
| Дозировка | 90 мг |
| Первичная упаковка | Блистер |
| Температура хранения | от 5 °С до 25 °С |
| Срок годности | 3 года |
| Код Морион | 894011 |
| Упаковка | По 14 таблеток в блистере. По 4 блистера в картонной коробке |
| Рецептурный отпуск | по рецепту |
| Форма выпуска | Таблетки |
| Кол-во в упаковке | 56 |
| Способ введения | орально |
| Производитель |
Кому можна
| Аллергикам | с осторожностью |
| Водителям | с осторожностью |
| Беременным | запрещено |
| Кормящим матерям | с осторожностью |
| Детям | запрещено |
Перед публикацией Ваш отзыв может быть отредактирован для исправления грамматики, орфографии или удаления неприемлемых слов и контента. Отзывы, которые, как нам кажется, созданы заинтересованными сторонами, не будут опубликованы. Старайтесь рассказывать о собственном опыте, избегая обобщений.
Альминда таблетки по 90 мг, 56 шт. - Инструкция по применению
Состав
1 таблетка, покрытая плёночной оболочкой, содержит 90 мг тикагрелора;
другие составляющие: маннит (Е 421), кальция гидрофосфат, натрия крахмальгликолят (тип А), гидроксипропилцеллюлоза, магния стеарат, гипромелоза 2910, титана диоксид (Е 171), тальк, полиэтиленгликоль 400, железа оксид желтый (Е 172).
Лекарственная форма
Основные физико-химические свойства: круглые, двояковыпуклые, желтые, покрытые пленочной оболочкой таблетки с гравировкой с одной стороны и гладкие с другой.
Фармакотерапевтическая группа
Фармакодинамика
Лекарственное средство Альминда содержит тикагрелор, который относится к химическому классу циклопентилтриазолопиримидинов (ЦПТП) и является пероральным, селективным и обратно связывающим антагонистом рецепторов P2Y12 прямого действия, предотвращающего аденозиндифосфат (АДФ). . Тикагрелор не предотвращает связывание АДФ, но, будучи связанным с рецептором P2Y12, препятствует АДФ-индуцированной передаче сигналов. Поскольку тромбоциты принимают участие в инициации и/или развитии тромботических осложнений атеросклероза, угнетение функции тромбоцитов, как было показано, уменьшает риск сердечно-сосудистых (СС) событий, таких как смерть, инфаркт миокарда (ИМ) или инсульт.
Тикагрелор также повышает местные уровни эндогенного аденозина, подавляя уравновешивающий нуклеозидный транспортер подтипа 1 (ENT-1).
Тикагрелор усиливает следующие индуцированные аденозином эффекты у здоровых лиц и у пациентов с острым коронарным синдромом (ОКС): вазодилатацию (определяемую по усилению коронарного кровотока у здоровых добровольцев и пациентов с ОКС; головная боль), угнетение функции тромбоцитов (в цельной крови человека) ) и одышку. Однако связь между наблюдаемым повышением уровней аденозина и клиническими результатами (например, заболеваемость, смертность) четко не установлена.
Фармакодинамические эффекты
Начало действия
У пациентов со стабильной ишемической болезнью сердца (ИБС), получавших ацетилсалициловую кислоту (АСК), фармакологический эффект тикагрелора проявлялся быстро, о чем свидетельствовал средний показатель угнетения агрегации тромбоцитов (ПАД) тикагрелором до 0,5 ч после применения нагрузки. примерно 41%. Максимальный эффект ПАД на уровне 89% достигался через 2–4 часа после применения дозы и сохранялся в течение 2–8 часов. У 90% пациентов окончательный показатель ПАД через 2 ч после применения дозы составил > 70%.
Конец действия
Если планируется процедура аортокоронарного шунтирования (АКШ), риск кровотечения у пациентов, применяющих тикагрелор, повышен по сравнению с получающими клопидогрель в случае прекращения терапии менее чем за 96 часов до процедуры.
Данные по переходу с одного лекарственного средства на другое
Переход с приема клопидогреля в дозе 75 мг на тикагрелор в дозе 90 мг дважды в сутки приводит к абсолютному увеличению ПАД на 26,4%, а переход с тикагрелора на клопидогрель приводит к абсолютному снижению ПАД на 24,5%. Пациенты могут быть переведены с клопидогреля на тикагрелор без прерывания антитромбоцитарного эффекта (см. «Способ применения и дозы»).
Клиническая эффективность и безопасность
Клинические доказательства эффективности и безопасности применения тикагрелора были получены в двух исследованиях ІІІ фазы:
Исследование PLATO [PLATelet Inhibition and Patient Outcomes – угнетение тромбоцитов и последствия для пациентов], в котором сравнивали тикагрелор и клопидогрель при применении их в комбинации с АСК и другой стандартной терапией.
Исследование PEGASUS TIMI-54 [PrEvention with TicaGrelor of SecondAry Thrombotic Events in High-RiSk AcUte Coronary Syndrome Patients – Профилактика вторичных тромботических событий у пациентов с ОКС из группы высокого риска с помощью тикагрелора], в ком АСУ.
Исследование PLATO (острый коронарный синдром)
В исследовании PLATO принимали участие 18624 пациента с симптомами нестабильной стенокардии (НС), инфаркта миокарда без подъема сегмента ST (ИМбпST) или инфаркта миокарда с подъемом сегмента ST (ИМпST) за последние 24 часа, которые лечили медикаментозно. ) или АКШ.
Клиническая эффективность
На фоне ежедневного приема АСК применение тикагрелора 90 мг дважды в сутки было более эффективным, чем клопидогреля 75 мг в сутки, для предотвращения первичной комбинированной конечной точки (ПККТ), включавшей СС смерть, инфаркт миокарда (ИМ) или инсульт, по разнице СС смерти и ИМ. Пациенты получали дозу нагрузки 300 мг клопидогреля (в случае ПКВ – возможно, 600 мг) или 180 мг тикагрелора.
Эффект достигался быстро, со снижением абсолютного риска (ЗАР) на 0,6% и снижением относительного риска (ЗВР) на 12% через 30 суток и сохранялся в течение всего 12-месячного периода лечения, при этом абсолютный риск снижался на 1,9% за год, а относительный риск – на 16%. Это свидетельствует о целесообразности лечения тикагрелором, который применяют в дозе 90 мг дважды в сутки в течение 12 месяцев (см. раздел «Способ применения и дозы»). Лечение 54 пациентов с ГКС тикагрелором вместо клопидогреля позволит предотвратить 1 атеротромботическое событие; лечение тикагрелором 91 пациента позволит предотвратить 1 СС смерти (см. рисунок 1 и таблицу 4).
Большая эффективность тикагрелора по сравнению с клопидогрелем не зависела от массы тела или пола пациента, наличия у него сахарного диабета, транзиторной ишемической атаки (ТИА) или негеморрагического инсульта, реваскуляризации, сопутствующей терапии лекарственными средствами, включая гепарины, ингибиторы и ингибиторы. (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»). Эффективность не зависела от способа лечения, выбранного в момент рандомизации (инвазивное или медикаментозное), как у пациентов с НС, ИМбпST, так и у пациентов с ИМпST.
Отношение рисков (ВР) для ПККТ свидетельствовало в пользу тикагрелора в других странах мира, кроме Северной Америки, которая составляла примерно 10% всей популяции исследования (p-значение = 0,045). Поисковый анализ свидетельствует о возможном взаимодействии с дозой АСК, поскольку увеличение дозы АСК ассоциировалось с уменьшением эффективности тикагрелора. Дозы АСК для постоянного ежедневного применения одновременно с тикагрелором должны составлять 75–150 мг (см. раздел «Способ применения и дозы» и «Особенности применения»).
На рисунке 1 показана оценка риска первого появления любого события в комбинированной конечной точке эффективности.
Рис. 1. Анализ первичной клинической комбинированной конечной точки СС смерти, ИМ и инсульта (исследование PLATO)
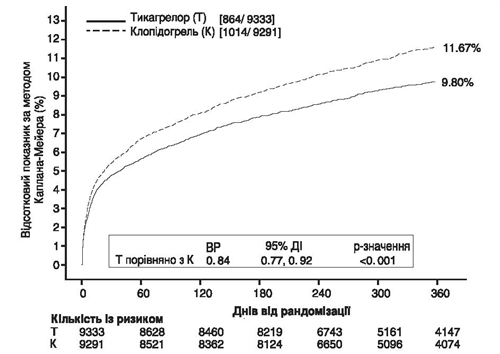
Тикагрелор снижал частоту событий первичной комбинированной конечной точки по сравнению с клопидогрелем как в популяции НС/инфаркта миокарда без подъема сегмента ST, так и в популяции инфаркта миокарда с подъемом сегмента ST (таблица 1). Таким образом, лекарственное средство Альминда по 90 мг дважды в сутки в сочетании с низкими дозами АСК можно применять пациентам с ГКС (нестабильная стенокардия, инфаркт миокарда без подъема сегмента ST [NSTEMI] или инфаркт миокарда с подъемом сегмента ST [STEMI]), включая пациентами, получающими стандартное медикаментозное лечение, и теми, кому проводили перкутанное коронарное вмешательство (ПКВ) или аортокоронарное шунтирование (АКШ).
Таблица 1. Анализ первичной и вторичной конечных точек эффективности (исследование PLATO)
Тикагрелор, 90 мг двічі на добу (% пацієнтів із подіями) N = 9333 |
Клопідогрель, 75 мг один раз на добу (% пацієнтів із подіями) N = 9291 |
ЗАРa (%/рік) |
ЗВРa (%) (95 % ДІ) |
p-значення |
|
СС смерть, ІМ (за винятком безсимптомної форми ІМ) або інсульт |
9,3 |
10,9 |
1,9 |
16 (8; 23) |
0,0003 |
Інвазивний метод |
8,5 |
10,0 |
1,7 |
16 (6; 25) |
0,0025 |
Медикаментозний метод |
11,3 |
13,2 |
2,3 |
15 (0,3; 27) |
0,0444г |
СС смерть |
3,8 |
4,8 |
1,1 |
21 (9; 31) |
0,0013 |
ІМ (за винятком безсимптомної форми ІМ)б |
5,4 |
6,4 |
1,1 |
16 (5; 25) |
0,0045 |
Інсульт |
1,3 |
1,1 |
|
|
0,2249 |
Смерть через будь-яку іншу причину, ІМ (за винятком безсимптомної форми ІМ) або інсульт |
9,7 |
11,5 |
2,1 |
16 (8; 23) |
0,0001 |
СС смерть, загальна кількість ІМ, СРІ, РІ, ТІА або інша АТПв |
13,8 |
15,7 |
2,1 |
12 (5; 19) |
0,0006 |
Смертність через будь-яку причину |
4,3 |
5,4 |
1,4 |
22 (11; 31) |
0,0003г |
Визначений тромбоз стента |
1,2 |
1,7 |
0,6 |
32 (8; 49) |
0,0123г |
a¦ЗАР – снижение абсолютного риска; ЗВР – снижение относительного риска = (1-соотношение рисков) 100%. Отрицательный показатель ЗВР показывает увеличение показателя относительного риска.
б¦За исключением бессимптомной формы ИМ.
в СРИ – серьезная рецидивирующая ишемия; РИ – рецидивирующая ишемия; ТИА – транзиторная ишемическая атака; АТП – артериальное тромботическое событие. Общее количество случаев ИМ включает случаи бессимптомного ИМ; Дата сообщения о событии установлена как дата события.
г Номинальный уровень значимости; все остальные формально статистически значимы по результатам определенного заранее многоуровневого тестирования.
Генетическое дополнительное исследование PLATO
Генотипирование 10285 пациентов по CYP2C19 и ABCB1 в исследовании PLATO установило связь между группами по генотипу и результатами исследования PLATO. Преимущества тикагрелора над клопидогрелем в снижении частоты серьезных СС событий не в значительной степени зависели от генотипа CYP2C19 или ABCB1 пациентов. Общая частота обширных кровотечений в исследовании PLATO не отличалась в группах тикагрелора и клопидогреля независимо от генотипа CYP2C19 или ABCB1. Частота не связанных с АКШ больших кровотечений по определению исследования PLATO была повышена при применении тикагрелора по сравнению с клопидогрелем у пациентов с отсутствием одного или нескольких функциональных аллелей CYP2C19, но подобной таковой при применении клопидогреля у пациентов без потери функциональных аллелей.
Комплексная составляющая эффективности и безопасности
Комплексная составляющая эффективности и безопасности (СС смерть, ИМ, инсульт или общее количество крупных кровотечений по определению исследования PLATO) указывает на то, что преимущества эффективности тикагрелора по сравнению с клопидогрелем не нивелируются случаями крупных кровотечений (ЗАР – 1,4%, ЗВР – 8%). , ВР – 0,92;
Клиническая безопасность
Холтеровское дополнительное исследование
Для изучения возникновения желудочковой асистолии и других эпизодов аритмии в рамках исследования PLATO исследователи провели холтеровское мониторирование в подгруппе из почти 3000 пациентов, из которых около 2000 имели записи как в острой фазе ГКС, так и через один месяц. Основным переменным, которое исследовалось, было появление желудочковой асистолии ≥3 секунд. По данным холтеровского мониторинга, пациентов с эпизодами желудочковой асистолии ≥ 3 секунд в острой фазе ОКС было больше в группе тикагрелора (6,0%), чем в группе клопидогреля (3,5%) и 2,2% и 1,6% соответственно через 1 месяц (см. раздел «Особенности применения»); в группе тикагрелора такие эпизоды чаще наблюдались у пациентов с хронической сердечной недостаточностью (ХСН) (9,2% против 5,4% у пациентов без ХСН в анамнезе; для пациентов в группе клопидогреля – 4,0% против 3,6% соответственно) , однако статистически значимой разницы между группами тикагрелора и клопидогреля через 1 месяц не отмечалось (2,0% против 2,1% для пациентов, принимавших тикагрелор, с ХСН и без нее соответственно, и 3,8% против 1,4% в нежелательных клинических последствий (в том числе синкопе или необходимость установления кардиостимулятора), обусловленных таким расхождением в этой популяции пациентов не наблюдалось.
Исследование PEGASUS (инфаркт миокарда в анамнезе)
Исследование PEGASUS TIMI-54 – рандомизированное, двойно слепое, плацебо-контролируемое, в параллельных группах, международное многоцентровое исследование типа «случай-контроль» с участием 21162 пациентов, проводившееся для оценки профилактики атеротромботических событий с помощью тикагрелора2 90 мг дважды в сутки или 60 мг дважды в сутки) в комбинации с низкими дозами АСК (75–150 мг) по сравнению с терапией только АСК у пациентов с ИМ в анамнезе и наличием дополнительных факторов риска атеротромбоза.
Критерии включения в исследование: возраст ≥ 50 лет, ИМ в анамнезе (за 1–3 года до рандомизации) и хотя бы один из факторов риска атеротромбоза: возраст ≥ 65 лет, сахарный диабет с необходимостью медикаментозного лечения, второй ИМ в анамнезе, признаки ИБС с множественным поражением сосудов или хронической почечной недостаточностью (НН) не в терминальной стадии.
Критериями исключения было запланировано применение антагониста рецепторов P2Y12, дипиридамола, цилостазола или антикоагулянтной терапии в течение периода исследования; нарушение свертывания крови, ишемический инсульт или внутричерепное кровоизлияние (ВЧК) в анамнезе, опухоль центральной нервной системы или аномалия внутричерепных сосудов; желудочно-кишечное кровотечение в течение предыдущих 6 месяцев или обширное хирургическое вмешательство в течение предыдущих 30 суток.
Клиническая эффективность
Рис. 2. Анализ первичной клинической комбинированной конечной точки СС смерти, ИМ и инсульта (исследование PEGASUS)
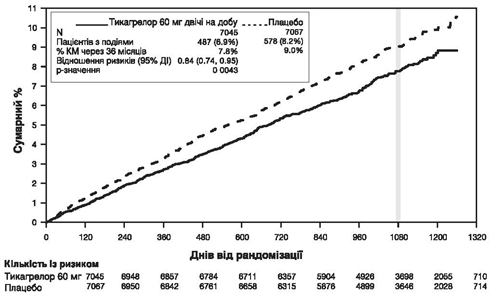
Таблица 2. Анализ первичной и вторичной конечных точек эффективности (исследование PEGASUS)
Характеристика |
Тикагрелор, 60 мг двічі на добу + АСК, N = 7045 |
Тільки АСК N = 7067 |
p-значення |
|||
Пацієнти з подіями |
% КМ |
ВР (95 % ДІ) |
Пацієнти з подіями |
% КМ |
||
Первинна кінцева точка |
||||||
Комбінована кінцева точка СС смерть/ІМ/інсульт |
487 (6,9 %) |
7,8 % |
0,84 (0,74; 0,95) |
578 (8,2 %) |
9,0 % |
0,0043 (з) |
СС смерть |
174 (2,5 %) |
2,9 % |
0,83 (0,68; 1,01) |
210 (3,0 %) |
3,4 % |
0,0676 |
ІМ |
285 (4,0 %) |
4,5 % |
0,84 (0,72; 0,98) |
338 (4,8 %) |
5,2 % |
0,0314 |
Інсульт |
91 (1,3 %) |
1,5 % |
0,75 (0,57; 0,98) |
122 (1,7 %) |
1,9 % |
0,0337 |
Вторинна кінцева точка |
||||||
СС смерть |
174 (2,5 %) |
2,9 % |
0,83 (0,68; 1,01) |
210 (3,0 %) |
3,4 % |
- |
Смертність через будь-яку причину |
289 (4,1 %) |
4,7 % |
0,89 (0,76; 1,04) |
326 (4,6 %) |
5,2 % |
- |
Соотношение рисков и p-значения подсчитывали отдельно для тикагрелора и терапии только АСК с помощью модели пропорциональных рисков Кокса с группой лечения как с единственной переменной.
Процентный показатель по методу Каплана – Мейера, подсчитанный через 36 месяцев.
Примечание: количество первых событий для компонентов СС смерть, ИМ и инсульт являются фактическим количеством первых событий для каждого компонента и не добавляются в число событий в комбинированной конечной точке.
(с) Указывает на статистическую значимость.
ДИ – доверительный интервал; СС – сердечно-сосудистая; Ср. – соотношение рисков; КМ – метод Каплана – Мейера; ИМ – инфаркт миокарда; N – количество пациентов.
Применение тикагрелора в дозах 60 мг дважды в сутки и 90 мг дважды в сутки в комбинации с АСК было более эффективным для профилактики атеротромботических событий по сравнению с применением только АСК (комплексная конечная точка: СС смерть, ИМ и инсульт) со стабильным эффектом лечения в течение всего периода исследования, ЗВР на 16% и ЗАР на 1,27% при применении тикагрелора в дозе 60 мг и на 15% и 1,19% соответственно при применении тикагрелора в дозе 90 мг.
На фоне подобия профилей эффективности доз 90 мг и 60 мг более низкая доза продемонстрировала лучший профиль безопасности относительно риска кровотечения и одышки. Поэтому только лекарственное средство Альминда в дозе 60 мг дважды в сутки в комбинации с АСК рекомендуется для профилактики атеротромботических событий (СС смерти, ИМ и инсульта) у пациентов с ИМ в анамнезе и высоким риском развития атеротромботических событий.
По сравнению с монотерапией АСК тикагрелор в дозе 60 мг дважды в день значительно снижал частоту ПККТ (СС смерть, ИМ и инсульт). Снижение частоты ПККТ было обусловлено снижением частоты каждого из компонентов (ЗВР СС смерти на 17%, ЗВР ИМ на 16% и ЗВР инсульта на 25%).
ЗВР комплексной конечной точки с 1-х по 360-е сутки (ЗВР на 17 %) и с 361-х суток и далее (ЗВР на 16 %) было практически одинаковым. Данные по эффективности и безопасности применения тикагрелора при продолжении лечения более 3 лет ограничены.
Не было получено доказательств преимущества (отсутствие снижения частоты ПККТ (СС смерть, ИМ и инсульт) и роста частоты больших кровотечений) применения тикагрелора в дозе 60 мг дважды в сутки у клинически стабильных пациентов более чем через 2 года после перенесенного ИМ или более чем через 1 год после прекращения предварительного лечения ингибитором АДФ (см. также раздел «Способ применения и дозы»).
Клиническая безопасность
Частота преждевременного прекращения применения тикагрелора в дозе 60 мг в связи с кровотечением и одышкой была выше у пациентов старше 75 лет (42%) по сравнению с пациентами младшего возраста (диапазон: 23–31%), с разницей по сравнению с плацебо. более 10% (42% против 29%) у пациентов в возрасте > 75 лет.
Дети
В рандомизированном, двойно слепом исследовании ІІІ фазы с параллельными группами (HESTIA 3) 193 пациента детского возраста (от 2 до 18 лет) с серповидноклеточной анемией были рандомизированы в группу плацебо или тикагрелора в дозах от 15 мг до 4 массы тела. В группе применения тикагрелора медиана угнетение тромбоцитов составляло 35% до применения лекарственного средства и 56% через два часа после применения лекарственного средства в равновесном состоянии.
По сравнению с плацебо не было выявлено преимущества тикагрелора по влиянию на частоту развития вазоокклюзивных кризов.
Европейское агентство по лекарственным средствам отказалось от обязательства подавать результаты исследований лекарственного средства Альминда во всех подгруппах педиатрической популяции с острым коронарным синдромом (ГКС) и инфарктом миокарда (ИМ) в анамнезе (см. способ применения и дозы), чтобы получить информацию о применении детям).
Фармакокинетика
Абсорбция
Тикагрелор быстро всасывается с медианой tmax примерно 1,5 часа. Образование основного циркулирующего метаболита тикагрелора AR-C124910XX (также активного) происходит быстро, медиана tmax – примерно 2,5 часа. После перорального применения разовой дозы 90 мг тикагрелора натощак здоровыми добровольцами Cmax составляла 529 нг/мл, а AUC – 3451 нг*часа/мл. Соотношение метаболита и исходного соединения равно 0,28 для Cmax и 0,42 для AUC.
Фармакокинетика тикагрелора и AR-C124910XX у пациентов с ИМ в анамнезе была в целом похожа на наблюдавшуюся в популяции пациентов с ОКС. По результатам популяционного фармакокинетического анализа PEGASUS медиана Cmax тикагрелора составляла 391 нг/мл, а AUC – 3801 нг*часа/мл в равновесном состоянии при применении в дозе 60 мг. Для тикагрелора в дозе 90 мг Cmax составляла 627 нг/мл, а AUC – 6255 нг*часа/мл в равновесном состоянии.
Рассчитано, что абсолютная средняя биодоступность тикагрелора составляет 36%. Потребление богатой жирами пищи приводило к росту AUC тикагрелора на 21% и снижению Cmax активного метаболита на 22%, но не влияло на Cmax тикагрелора или AUC активного метаболита. Эти изменения имеют минимальное клиническое значение, поэтому тикагрелор можно применять независимо от еды. Тикагрелор и его активный метаболит являются субстратами P-gp.
Тикагрелор в виде измельченных таблеток, смешанных с водой, в случае его перорального применения или введения через назогастральный зонд в желудок имеет биодоступность, сравнимую с таковой у тикагрелора в виде целых таблеток в отношении AUC и Cmax тикагрелора и его активного метаболита. Начальная экспозиция (через 0,5 и 1 ч после применения дозы) в случае приема измельченных и смешанных с водой таблеток тикагрелора была выше, чем начальная экспозиция при приеме целых таблеток, с, как правило, одинаковым профилем концентраций в дальнейшем (через 2–48 часов ).
Распределение
Равновесный объем распределения тикагрелора составляет 87,5 л. Тикагрелор и его активный метаболит значительно связываются с белками плазмы крови человека (> 99,0%).
Биотрансформация
CYP3A4 является основным ферментом, отвечающим за метаболизм тикагрелора и образование активного метаболита, а их взаимодействие с другими субстратами CYP3A колеблется от активации к угнетению.
Основным метаболитом тикагрелора является AR-C124910XX, также активный, о чем свидетельствует связывание in vitro с тромбоцитарными АДФ-рецепторами P2Y12. Системная экспозиция активного метаболита составляет около 30-40% от системной экспозиции тикагрелора.
Вывод
Основным путем выведения тикагрелора является печеночный метаболизм. При применении меченого радиоактивным изотопом тикагрелора средний уровень выведенной радиоактивной метки составляет примерно 84% (57,8% в кале и 26,5% в моче). Содержание тикагрелора и активного метаболита в моче составляло менее 1% дозы. Основным путем выведения активного метаболита, наиболее вероятно, есть секреция с желчью. Средний t1/2 тикагрелора составил примерно 7 часов, активного метаболита – 8,5 часов.
Особые группы пациентов
Пациенты пожилого возраста
По данным популяционного фармакокинетического анализа у пациентов пожилого возраста (в возрасте ≥ 75 лет) с ОКС наблюдались более высокие показатели экспозиции тикагрелора (приблизительно на 25% как для Cmax, так и для AUC) и активного метаболита, чем у пациентов младшего возраста. Эти отличия не считаются клинически значимыми (см. «Способ применения и дозы»).
Дети
Данные о применении тикагрелора детям с серповидноклеточной анемией ограничены (см. раздел «Способ применения и дозы» и «Фармакодинамика»).
В исследовании HESTIA 3 пациенты в возрасте от 2 до 18 лет с массой тела от ≥ 12 до ≤ 24 кг, от > 24 до ≤ 48 кг и > 48 кг получали тикагрелор в форме детских таблеток для рассасывания по 15 мг в дозах соответственно 15, 30 и 45 мг два раза в день. По результатам фармакокинетического анализа в указанной популяции среднее значение AUC тикагрелора колебалось в диапазоне от 1095 нг*часов/мл до 1458 нг*часов/мл, а среднее значение Cmax – от 143 нг/мл до 206 нг/мл в равновесном состоянии.
Пол
У женщин отмечались более высокие экспозиции тикагрелора и активного метаболита, чем у мужчин. Эти отличия не считаются клинически значимыми.
Нарушение функции почек
Экспозиция тикагрелора была примерно на 20% ниже, а экспозиция активного метаболита приблизительно на 17% выше у пациентов с тяжелым нарушением функции почек (клиренс креатинина < 30 мл/мин), чем у пациентов с нормальной функцией почек.
У пациентов с терминальной стадией НН, проходящих гемодиализ, значения AUC и Cmax тикагрелора, 90 мг, в случае применения лекарственного средства в день, когда гемодиализ не проводился, были на 38% и 51% выше по сравнению с таковыми у пациентов с нормальной функцией. почек. Подобное увеличение экспозиции наблюдалось при применении тикагрелора непосредственно перед диализом (49% и 61% соответственно), что свидетельствует о том, что тикагрелор не выводится из организма с помощью диализа. Экспозиция активного метаболита увеличивалась в меньшей степени (AUC 13–14% и Cmax 17–36%). Ингибирование агрегации тромбоцитов (ИАГ) тикагрелором не зависело от диализа у пациентов с терминальной стадией почечной болезни и было сходным у пациентов с нормальной функцией почек (см. способ применения и дозы).
Нарушение функции печени
Cmax и AUC тикагрелора были соответственно на 12% и 23% выше у пациентов с нарушением функции печени легкой степени по сравнению с соответствующими показателями у здоровых добровольцев, однако эффект ПАО тикагрелора был схож для обеих групп. Коррекция дозировки для пациентов с нарушением функции печени легкой степени не требуется. Применение тикагрелора пациентам с нарушением функции печени в тяжелой степени не изучалось; информации о фармакокинетике у пациентов с нарушением функции печени умеренной степени нет. У пациентов с умеренным или выраженным повышением одного или нескольких лабораторных показателей функции печени на исходном уровне, плазменные концентрации тикагрелора в среднем были подобными или несколько выше по сравнению с таковыми у пациентов без отклонений на исходном уровне. Коррекция дозирования для пациентов с нарушением функции печени умеренной степени не требуется (см. раздел «Способ применения и дозы» и «Особенности применения»).
Этническая принадлежность
У пациентов азиатского происхождения средняя биодоступность на 39% выше, чем у пациентов европеоидной расы. У пациентов негроидной расы биодоступность тикагрелора была на 18% ниже, чем у пациентов европеоидной расы; В ходе исследования клинической фармакологии экспозиция (Cmax и AUC) тикагрелора у японцев была примерно на 40% (на 20% после поправки на массу тела) выше, чем у представителей европеоидной расы. Экспозиция лекарственного средства у пациентов испанского или латиноамериканского происхождения была подобна таковой у пациентов европеоидной расы.
Показания
- острым коронарным синдромом (ГКС) или
- инфарктом миокарда (ИМ) в анамнезе и высоким риском развития атеротромботических событий (см. раздел «Способ применения и дозы» и «Фармакодинамика»).
Противопоказания
- Гиперчувствительность к действующему веществу или любому из вспомогательных веществ (см. раздел «Побочные реакции»).
- Активное патологическое кровотечение.
- Внутричерепное кровоизлияние в анамнезе (см. раздел «Побочные реакции»).
- Нарушение функции печени тяжелой степени (см. раздел «Способ применения и дозы», «Особенности применения» и «Фармакокинетика»).
- Одновременное применение тикагрелора с мощными ингибиторами CYРЗА4 (например кетоконазолом, кларитромицином, нефазодоном, ритонавиром и атазанавиром) противопоказано, поскольку их одновременное применение может привести к значительному увеличению экспозиции тикагрелора (см. раздел «Взаимодействие» с другими лекарственными средствами).
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Воздействие лекарственных средств и других средств на тикагрелор
Ингибиторы CYP3A4
- Мощные ингибиторы CYP3A4: одновременное применение кетоконазола и тикагрелора приводило к повышению Cmax и AUC тикагрелора в 2,4 и 7,3 раза соответственно. Cmax и AUC активного метаболита снижались на 89% и 56% соответственно. Ожидается, что другие мощные ингибиторы CYP3A4 (кларитромицин, нефазодон, ритонавир и атазанавир) будут оказывать такое же влияние, поэтому одновременное применение мощных ингибиторов CYP3A4 с тикагрелором противопоказано (см. раздел «Противопоказания»).
- Умеренные ингибиторы CYP3A4: одновременное применение дилтиазема с тикагрелором приводило к увеличению Cmax тикагрелора на 69% и AUC в 2,7 раза, а также к снижению Cmax активного метаболита на 38%, при этом его AUC оставалась неизмененной. Влияния тикагрелора на плазменные уровни дилтиазема не наблюдалось. Ожидается, что другие умеренные ингибиторы CYP3A4 (например, ампренавир, апрепитант, эритромицин и флуконазол) будут оказывать такое же влияние, поэтому их можно применять одновременно с тикагрелором.
- После ежедневного потребления грейпфрутового сока в больших количествах (3×200 мл) наблюдалось увеличение экспозиции тикагрелора в 2 раза. Не ожидается, что такое увеличение экспозиции будет иметь клиническое значение для большинства пациентов.
Одновременное применение рифампицина с тикагрелором приводило к снижению Cmax и AUC тикагрелора на 73% и 86% соответственно. Cmax активного метаболита оставалась неизмененной, тогда как AUC снижалась на 46%. Ожидается, что другие индукторы CYP3A (например, фенитоин, карбамазепин и фенобарбитал) также будут приводить к снижению экспозиции тикагрелора. Одновременное применение тикагрелора с мощными индукторами CYP3A может приводить к снижению экспозиции и эффективности тикагрелора, поэтому их одновременное применение с тикагрелором не рекомендуется.
Циклоспорин (ингибитор P-gp и CYP3A)
Одновременное применение циклоспорина (600 мг) и тикагрелора приводило к повышению Cmax и AUC тикагрелора в 2,3 и 2,8 раза соответственно. В присутствии циклоспорина AUC активного метаболита возрастала на 32%, а Cmax снижалась на 15%.
Данные по одновременному применению тикагрелора с другими действующими веществами, также являющимися мощными ингибиторами P-gp и умеренными ингибиторами CYРЗА4 (например с верапамилом, хинидином) и могут вызывать рост экспозиции тикагрелора, отсутствуют. Если комбинации нельзя избежать, одновременное применение этих лекарственных средств следует осуществлять с осторожностью.
Другие
Исследования клинического фармакологического взаимодействия показали, что одновременное применение тикагрелора с гепарином, эноксапарином и АСК или десмопрессином не влияет на фармакокинетику тикагрелора или его активного метаболита, или на АДФ-индуцированную агрегацию тромбоцитов по сравнению с применением только. При наличии клинических показаний лекарственные средства, оказывающие влияние на гемостаз, следует с осторожностью применять в комбинации с тикагрелором.
У пациентов с ОКС, получавших морфий, наблюдалась задержка и уменьшение экспозиции пероральных ингибиторов P2Y12, в том числе тикагрелора и его активных метаболитов (уменьшение влияния тикагрелора на 35%). Это взаимодействие может быть связано с пониженной моторикой желудочно-кишечного тракта (ЖКТ) и применяться к другим опиоидным средствам. Клиническая значимость такого взаимодействия не известна, но данные указывают на возможное снижение эффективности тикагрелора у пациентов, получающих тикагрелор и морфий одновременно. Для пациентов с ГКС, которым применение морфия нельзя отложить, а быстрое ингибирование P2Y12 считается жизненно важным, может быть рассмотрена возможность применения ингибитора P2Y12 с парентеральным введением.
Воздействие тикагрелора на другие лекарственные средства
Медицинские лекарственные средства CYP3A4
- Симвастатин: одновременное применение тикагрелора с симвастатином увеличивало Cmaxсимвастатина на 81% и AUC на 56%, а также увеличивало Cmaxсимвастатиновой кислоты на 64% и AUC на 52% (в отдельных случаях отмечалось увеличение в 2–3 раза). Одновременное применение тикагрелора с симвастатином в дозах свыше 40 мг в сутки может привести к побочным эффектам симвастатина, который следует сравнивать с ожидаемой пользой. Влияния симвастатина на плазменные уровни тикагрелора не наблюдалось. Тикагрелор может оказать подобное влияние на ловастатин. Одновременное применение тикагрелора с симвастатином или ловастатином в дозах более 40 мг не рекомендуется.
- Аторвастатин: одновременное применение аторвастатина и тикагрелора увеличивало Cmax аторвастатиновой кислоты на 23% и AUC на 36%. Подобное увеличение AUC и Cmax было отмечено у всех метаболитов аторвастатиновой кислоты. Такое увеличение не считают клинически значимым.
- Нельзя исключить подобное влияние на другие статины, метаболизируемые CYP3A4. Участники исследования PLATO, которые получатвали тикагрелор, принимали различные статины, и у 93% таких пациентов никаких проблем с безопасностью применения статинов не возникало.
Субстраты P-gp (в том числе дигоксин и циклоспорин)
Одновременное применение тикагрелора увеличивало Cmax дигоксина на 75%, а AUC – на 28%. Средние минимальные уровни дигоксина увеличивались примерно на 30% при одновременном применении тикагрелора, а в некоторых случаях наблюдалось максимальное увеличение в 2 раза. В присутствии дигоксина Cmax и AUC тикагрелора и его активного метаболита оставались неизменными. Поэтому при одновременном применении P-gp-зависимых лекарственных средств с узким терапевтическим индексом, таких как дигоксин, и тикагрелор рекомендуется надлежащий клинический и/или лабораторный мониторинг.
Воздействия тикагрелора на концентрацию циклоспорина в крови не наблюдалось. Воздействие тикагрелора на другие субстраты P-gp не изучали.
Метаболизируемые лекарственные средства CYP2С9
Одновременное применение тикагрелора с толбутамидом не изменяло плазменные уровни обоих лекарственных средств, что свидетельствует о том, что тикагрелор не является ингибитором CYP2C9, а потому маловероятно, что лекарственное средство будет влиять на CYP2C9-опосредованный метаболизм таких лекарственных средств, как варфарин и тол.
Розувастатин
Тикагрелор может оказывать влияние на выведение почками розувастатина, усиливая риск накопления последнего. Хотя точный механизм неизвестен, в некоторых случаях одновременное применение тикагрелора и розувастатина приводило к ухудшению функции почек, повышению креатинфосфокиназы (КФК) и рабдомиолиза.
Пероральные контрацептивы
Одновременное применение тикагрелора и левоноргестрела и этинилэстрадиола увеличивало экспозиции этинилэстрадиола примерно на 20%, но не изменяло фармакокинетики левоноргестрела. Не ожидается клинически значимого влияния на эффективность перорального контрацептива при одновременном применении левоноргестрела и этинилэстрадиола с тикагрелором.
Лекарственные средства, способные вызывать брадикардию
Поскольку наблюдались случаи преимущественно бессимптомной асистолии желудочков и брадикардии, следует с осторожностью применять тикагрелор одновременно с лекарственными средствами, способными вызывать брадикардию (см. раздел «Особенности применения»). Однако в исследовании PLATO не наблюдалось клинически значимых побочных реакций (ПР) после одновременного применения одного или нескольких лекарственных средств, способных вызывать брадикардию (например, 96% пациентов одновременно получали бета-блокаторы, 33% – блокаторы кальциевых каналов дилтиазем и верапамил и 4%). дигоксин).
Другая сопутствующая терапия
В ходе клинических исследований тикагрелор часто применяли вместе с АСК, ингибиторами протонной помпы (ИПП), статинами, бета-блокаторами, ингибиторами ангиотензинпревращающего фермента (АПФ) и блокаторами рецепторов ангиотензина (БРА) в течение длительного времени, как того нуждались в сопутствующих; а также с гепарином, низкомолекулярным гепарином и внутривенным введением ингибиторов GpIIb/IIIa в течение непродолжительного периода (см. раздел «Фармакодинамика»). Признаков клинически значимых нежелательных взаимодействий с этими лекарственными средствами не наблюдалось.
Одновременное применение тикагрелора с гепарином, эноксапарином или десмопрессином не влияло на активированное частичное тромбопластиновое время (аЧТВ), активированное время свертывания (АЧЗ) или на результаты количественного определения фактора Ха. Однако из-за возможных фармакодинамических взаимодействий следует с осторожностью применять тикагрелор одновременно с лекарственными средствами, способными влиять на гемостаз.
В связи с сообщениями о патологических кожных кровотечениях на фоне применения селективных ингибиторов обратного захвата серотонина (СИОС) (например пароксетина, сертралина и циталопрама) рекомендуется с осторожностью применять СИОЗС с тикагрелором, поскольку это может повысить риск кровотечения.
Особенности применения
Применение тикагрелора пациентам с известным повышенным риском кровотечения следует взвешивать, учитывая пользу от лекарственного средства в профилактике атеротромботических событий (см. разделы «Побочные реакции» и «Фармакодинамика»). При наличии клинических показаний тикагрелор следует с осторожностью применять следующим группам пациентов:
- Пациентам со склонностью к кровотечению (например, в связи с недавними травмами или хирургическими вмешательствами, расстройствами свертывания крови, активным или недавно перенесенным желудочно-кишечным кровотечением) или с повышенным риском травматизма. Применение тикагрелора противопоказано пациентам с активным патологическим кровотечением, ВЧК в анамнезе и пациентам с нарушением функции печени тяжелой степени (см. раздел «Противопоказания»).
- Пациентам, которые одновременно (в течение 24 ч после применения тикагрелора) применяют лекарственные средства, способные повышать риск кровотечения (например, нестероидные противовоспалительные лекарственные средства (НПВП), пероральные антикоагулянты и/или фибринолитические средства).
Применение антифибринолитических средств (аминокапроновой кислоты или транексамовой кислоты) и/или рекомбинантного фактора VIIа может повысить гемостаз. Применение тикагрелора можно восстановить после того, как причина кровотечения будет установлена и контролируется.
Хирургическое вмешательство
Пациентам необходимо посоветовать, чтобы они сообщали врачам и стоматологам, принимающим тикагрелор, до планирования любого хирургического вмешательства и перед применением нового лекарственного средства.
В исследовании PLATO у пациентов, которым проводилось АКШ, в группе тикагрелора, случаев кровотечения было больше, чем в группе клопидогреля, при прекращении терапии за 1 сутки до операции, но большие кровотечения наблюдались с такой же частотой, как и в группе клопидогреля, в при прекращении терапии за 2 или более суток до оперативного вмешательства (см. раздел «Побочные реакции»). Если пациент нуждается в плановом хирургическом вмешательстве и антитромбоцитарный эффект нежелателен, применение тикагрелора следует прекратить за 5 суток до операции (см. раздел «Фармакодинамика»).
Пациенты, перенесшие ишемический инсульт
Пациентам с ГКС, перенесшим ишемический инсульт, можно лечить тикагрелором до 12 месяцев (исследование PLATO).
В исследование PEGASUS не включали пациентов с ИМ в анамнезе, перенесших ишемический инсульт. Поэтому из-за отсутствия данных лечения продолжительностью более одного года таким пациентам не рекомендуется.
Нарушение функции печени
Применение тикагрелора противопоказано пациентам с нарушением функции печени тяжелой степени (см. раздел «Способ применения и дозы» и «Противопоказания»). Опыт применения тикагрелора пациентам с нарушением функции печени средней степени ограничен, поэтому рекомендуется с осторожностью применять лекарственное средство таким пациентам (см. раздел «Способ применения и дозы» и «Фармакокинетика»).
Пациенты с риском брадикардии
По результатам холтеровского ЭКГ мониторирования выявлено повышение частоты эпизодов преимущественно бессимптомной асистолии желудочков во время лечения тикагрелором по сравнению с клопидогрелем. Пациенты с повышенным риском брадикардии (например, пациенты без кардиостимулятора с синдромом слабости синусового узла, атриовентрикулярной блокадой 2-й или 3-й степени или синкопе, обусловленным брадикардией) не включались в основные исследования, в которых оценивали безопасность и эффективность применения тикагрелора. Поэтому в связи с ограниченным клиническим опытом тикагрелор следует с осторожностью применять таким пациентам (см. раздел Фармакодинамика).
Одновременное применение тикагрелора с лекарственными средствами, способными вызывать брадикардию, требует осторожности. Однако в исследовании PLATO не наблюдалось признаков клинически значимых побочных реакций (ПР) после одновременного применения одного или более лекарственных средств, способных вызывать брадикардию (например, 96% пациентов принимали бета-блокаторы, 33% - блокаторы кальциевых каналов дилтиазем и верапамил и 4% - дигоксин) (см. раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Во время дополнительного холтеровского исследования в рамках исследования PLATO эпизоды асистолии желудочков продолжительностью ≥ 3 секунд в течение острой фазы ГКС чаще наблюдались при применении тикагрелора, чем клопидогреля. Увеличение частоты выявленных с помощью холтеровского мониторинга эпизодов желудочковой асистолии при применении тикагрелора было более выраженным у пациентов с ХСН, чем в общей популяции исследования во время острой фазы ГКС, но это Ее разницы уже через один месяц лечения тикагрелором или по сравнению с клопидогрелем не наблюдалось. Нежелательных клинических последствий, связанных с таким расхождением (в том числе синкопе или возникновения необходимости установления кардиостимулятора), в этой популяции пациентов не наблюдалось (см. раздел «Фармакодинамика»).
В послерегистрационный период у пациентов, принимавших тикагрелор, сообщалось о случаях брадиаритмии и атриовентрикулярной блокады (см. раздел «Побочные реакции»), преимущественно у пациентов с ОКС, у которых ишемия сердца и прием сопутствующих лекарственных средств, снижающих частоту сердечных сокращений или влияющих на сердечную проводимость являются потенциальными факторами, осложняющими течение заболевания. Перед коррекцией лечения необходимо оценить состояние пациента и сопутствующие лекарственные средства как потенциальные причины.
Одышка
У пациентов, получавших тикагрелор, наблюдали одышку. Одышка обычно была легкой или умеренно выраженной и часто уходила без необходимости прекращения лечения. У пациентов с бронхиальной астмой (БА)/хроническим обструктивным заболеванием легких (ХОБЛ) абсолютный риск развития одышки при применении тикагрелора может быть повышен. Следует с осторожностью применять тикагрелор пациентам с БА и/или ХОБЛ в анамнезе. Механизм развития этого явления не выяснен. Если пациент сообщает о появлении, большей продолжительности или усилении одышки, следует провести полное обследование, а при наличии непереносимости лекарственного средства следует прекратить лечение тикагрелором. Подробную информацию см. в разделе «Побочные реакции».
Центральное апноэ во сне
Сообщалось о центральном апноэ во сне, включая дыхание Чейна – Стокса, в послерегистрационный период у пациентов, принимавших тикагрелор. Если есть подозрение на центральное апноэ во сне, следует рассмотреть возможность дальнейшего клинического обследования.
Повышение уровня креатинина
При лечении тикагрелором может повышаться уровень креатинина. Механизм развития этого явления не выяснен. Следует проверять функцию почек в соответствии со стандартами медицинской практики. У пациентов с ОКС рекомендуется также проверить функцию почек через месяц после начала лечения тикагрелором, уделяя особое внимание пациентам в возрасте ≥ 75 лет, пациентам с нарушением функции почек умеренной/тяжелой степени, а также одновременно применяющим БРА.
Повышение уровня мочевой кислоты
Во время лечения тикагрелором может возникать гиперурикемия (см. «Побочные реакции»). При лечении пациентов с гиперурикемией или подагрическим артритом в анамнезе следует соблюдать осторожность. Применение тикагрелора пациентам с мочекислой нефропатией не рекомендуется.
Тромботическая тромбоцитопеническая пурпура (ТТП)
На протяжении применения тикагрелора очень редко сообщалось о случаях тромботической тромбоцитопенической пурпуры (ТТП), характеризующейся тромбоцитопенией и микроангиопатической гемолитической анемией, связанной с результатами неврологического обследования, нарушением функции почек или лихорадкой. ТТП является потенциально летальным состоянием, требующим неотложного лечения с использованием плазмафереза.
Влияние на результаты анализа функции тромбоцитов для диагностики гепарининдуцированной тромбоцитопении (ГИТ)
В тесте гепарининдуцированной активации тромбоцитов (ГИАТ), используемого для диагностирования ГИТ, антитела к комплексу антитромбоцитарный фактор 4/гепарин в сыворотке крови пациента активируют тромбоциты здоровых доноров в присутствии гепарина.
У пациентов, получавших тикагрелор, сообщалось о ложноотрицательных результатах анализов функции тромбоцитов (в частности, тест ГИАТ и не только) для диагностирования ГИТ. Это обусловлено подавлением тикагрелором P2Y12-рецепторов тромбоцитов здорового донора в тесте сыворотки/плазмы пациента. Для интерпретации результатов анализа функции тромбоцитов на диагностирование ГИТ необходима информация об одновременном лечении тикагрелором.
У пациентов, у которых развилась ГИТ, необходимо провести оценку соотношения польза/риск продолжения лечения тикагрелором, учитывая как протромботическое состояние ГИТ, так и повышенный риск возникновения кровотечения при одновременном лечении антикоагулянтными средствами и тикагрелором.
Другое
Ввиду зависимости между поддерживающей дозой АСК и относительной эффективностью тикагрелора по сравнению с клопидогрелем, наблюдавшейся в исследовании PLATO, одновременное применение тикагрелора и высоких поддерживающих доз АСК (> 300 мг) не рекомендуется (см. раздел «Фармакодинамика»).
Лекарственное средство Альминда содержит менее 1 ммоль (23 мг)/дозу натрия, то есть практически свободно от натрия.
Преждевременное прекращение лечения
Преждевременное прекращение применения любого антитромбоцитарного средства, включая лекарственное средство Альминда, может привести к повышению риска СС смерти, ИМ или инсульта вследствие основного заболевания пациента. Поэтому преждевременной отмены лечения следует избегать.
Способность влиять на скорость реакции при управлении автотранспортом или работе с механизмами
Применение в период беременности или кормления грудью
Женщинам репродуктивного возраста следует применять соответствующие средства контрацепции во избежание беременности во время лечения тикагрелором.
Беременность
Данные по применению тикагрелора беременным женщинам отсутствуют или ограничены. В ходе исследований на животных была отмечена репродуктивная токсичность. Тикагрелор не рекомендуется для применения во время беременности.
Кормление грудью
Данные исследований фармакодинамики/токсикологии у животных свидетельствуют о том, что тикагрелор и его активный метаболит выделяются в грудное молоко. Невозможно исключить риск новорожденного/грудного ребенка. Решение о прекращении кормления грудью или прекращении/отказе от лечения тикагрелором необходимо принимать, учитывая пользу грудного кормления для ребенка и пользу терапии для женщины.
Репродуктивная функция
Тикагрелор не влиял на фертильность самцов и самок животных.
Способ применения и дозы
Пациентам, принимающим лекарственное средство Альминда, следует также ежедневно принимать АСК в поддерживающей дозе 75–150 мг, если для этого нет особых противопоказаний.
Острый коронарный синдром
Лечение лекарственным средством Альминда необходимо начинать с разовой дозы нагрузки 180 мг (две таблетки по 90 мг) и в дальнейшем принимать по 90 мг дважды в сутки. Рекомендованная продолжительность лечения лекарственным средством Альминда в дозе 90 мг у пациентов с ОКС составляет 12 месяцев при отсутствии клинических показаний для преждевременного прекращения лечения (см. раздел Фармакодинамика).
Инфаркт миокарда в анамнезе
Рекомендованная доза лекарственного средства Альминда для пациентов с ИМ в анамнезе, перенесенным не менее года назад, и высоким риском развития атеротромботических событий в случае необходимости длительного лечения составляет 60 мг 2 раза в сутки (см. раздел Фармакодинамика). Для пациентов с глюкокортикостероидами с высоким риском атеротромботических событий лечение можно начинать без перерыва – как продолжение терапии после первичного лечения лекарственным средством Альминда, 90 мг, или другим ингибитором рецепторов аденозиндифосфата (АДФ), которое длилось один год. Лечение можно начинать в течение периода до 2 лет после перенесенного ИМ или в течение одного года после окончания предыдущего курса лечения ингибитором АДФ-рецепторов. Данные по эффективности и безопасности применения тикагрелора при продолжении лечения более 3 лет ограничены.
При необходимости перехода из другого лекарственного средства на лекарственное средство Альминда первую дозу лекарственного средства Альминда следует принять через 24 ч после применения последней дозы другого антитромбоцитарного лекарственного средства.
Пропуск дозы
Следует также избегать пропусков приема лекарственного средства. Если пациент пропустил дозу лекарства Альминда, ему следует принять только одну таблетку (следующую дозу) в назначенное время.
Особые группы пациентов
Пациенты пожилого возраста
Коррекция дозы пациентам пожилого возраста не требуется (см. раздел Фармакодинамика).
Нарушение функции почек
Коррекция дозы пациентам с нарушением функции почек не требуется (см. раздел Фармакодинамика).
Нарушение функции печени
Применение тикагрелора пациентам с нарушением функции печени тяжелой степени не исследовали, поэтому применение лекарственного средства таким пациентам противопоказано (см. раздел «Противопоказания»). Информация о применении лекарственного средства пациентам с нарушением функции печени средней степени ограничена. Коррекция дозы не рекомендуется, но применять тикагрелор следует с осторожностью (см. разделы «Особенности применения» и «Фармакокинетика»). Коррекция дозы пациентам с нарушением функции печени легкой степени не требуется (см. раздел Фармакокинетика).
Способ применения
Для перорального применения.
Лекарственное средство Альминда можно применять независимо от еды.
Для пациентов, которые не могут проглотить целую таблетку, таблетку можно измельчить в порошок, смешать с половиной стакана воды и сразу выпить. Стакан необходимо промыть, использовав еще полстакана воды и выпить содержимое стакана. Смесь можно вводить через назогастральный зонд (СН8 или более). Важно промыть назогастральный зонд водой после введения смеси.
Дети
Нет релевантных данных о применении тикагрелора детям с серповидноклеточной анемией (см. раздел «Фармакологические свойства»).
Передозировка
При передозировке могут возникать вышеупомянутые потенциальные ПР, поэтому следует рассмотреть возможность ЭКГ-мониторинга.
До сих пор антидот для тикагрелора неизвестен; Тикагрелор не выводится с помощью диализа (см. раздел «Фармакокинетика»). Лечение передозировки следует проводить в соответствии с местными стандартами медицинской практики. Ожидаемым следствием чрезмерной дозировки тикагрелора является увеличение продолжительности риска кровотечения в связи с угнетением тромбоцитов. Маловероятно, что переливание тромбоцитарной массы будет эффективным методом лечения пациентов с кровотечением (см. раздел «Особенности применения»). В случае возникновения кровотечения следует принять другие соответствующие поддерживающие меры.
Побочные реакции
У дослідженні PLATO у пацієнтів, які отримували тикагрелор, частота передчасного припинення лікування через ПР була вищою, ніж у пацієнтів, які отримували клопідогрель (7,4 % проти 5,4 %). У дослідженні PEGASUS частота передчасного припинення лікування через ПР була вищою у пацієнтів, які отримували тикагрелор, порівняно з пацієнтами, які отримували тільки АСК (16,1 % при застосуванні тикагрелору в дозі 60 мг з АСК проти 8,5 % при застосуванні тільки АСК). Найбільш частими ПР у пацієнтів, які отримували лікування тикагрелором, були кровотеча і задишка (див. розділ «Особливості застосування»).
Наведені нижче ПР були виявлені у ході клінічних досліджень або про них повідомляли під час постмаркетингового застосування тикагрелору (таблиця 3).
Побічні реакції наведено за класами систем органів згідно з Медичним словником нормативно-правової діяльності (MedDRA). В межах кожного класу системи органів ПР класифіковано за частотою. Групи за частотою визначаються за такими критеріями: дуже часті (≥ 1/10), часті (від ≥ 1/100 до < 1/10); нечасті (від ≥ 1/1000 до < 1/100); рідкісні (від ≥ 1/10000 до < 1/1000); дуже рідкісні (< 1/10000); частота невідома (не може бути розрахована за наявними даними).
Таблиця 3. Побічні реакції за частотою та класами систем органів
Класи систем органів |
Дуже часті |
Часті |
Нечасті |
Частота невідома |
Доброякісні, злоякісні та неуточнені новоутворення (у тому числі кісти та поліпи) |
Кровотечі з пухлиниa |
|||
З боку крові та лімфатичної системи |
Кровотечі на фоні порушення згортання кровіб |
Тромботична тромбоцитопеніч-на пурпурав |
||
З боку імунної системи |
Гіперчутливість, у тому числі ангіоневротичний набрякв |
|||
Порушення обміну речовин і харчування |
Гіперурикеміяг |
Подагра/ подагричний артрит |
||
Психічні розлади |
Сплутаність свідомості |
|||
З боку нервової системи |
Запаморочення, синкопе, головний біль |
Внутрішньочерепний крововиливї |
||
З боку органів зору |
Крововилив в окоґ |
|||
З боку органів слуху та рівноваги |
Вертиго |
Вушний крововилив |
||
З боку серцево-судинної системи |
Брадіаритмія, атріовентрику-лярна блокадав |
|||
З боку судинної системи |
Артеріальна гіпотензія |
|||
Респіраторні, торакальні та медіастинальні порушення |
Задишка |
Кровотечі з органів диханняд |
||
Порушення з боку шлунково-кишкового тракту |
Шлунково-кишкова кровотечае, діарея, нудота, диспепсія, запор |
Ретроперитонеаль-ний крововилив |
||
Порушення з боку шкіри та підшкірної клітковини |
Крововиливи у підшкірну клітковину або у шкірує, висипання, свербіж |
|||
Порушення з боку кістково-м’язової системи та сполучної тканини |
Крововиливи у м’язиж |
|||
Порушення з боку нирок і сечовидільної системи |
Кровотечі із сечовивідних шляхівз |
|||
Порушення з боку репродуктивної системи та молочних залоз |
Кровотечі зі статевих органіви |
|||
Відхилення від норми, виявлені у результаті лабораторних досліджень |
Підвищений рівень креатиніну в кровіг |
|||
Травми, отруєння та ускладнення процедур |
Кровотеча після проведення процедури, травматичні кровотечіі |
a Наприклад кровотеча зі злоякісної пухлини сечового міхура, шлунка, товстої кишки.
б Наприклад підвищена схильність до утворення синців, спонтанна гематома, геморагічний діатез.
в Виявлено у постмаркетинговий період.
г Частота встановлена на основі лабораторних даних (підвищення рівня сечової кислоти > верхньої межі норми від вихідного рівня, що був нижчим від нормального діапазону або відповідав йому. Підвищення рівня креатиніну > 50 % від вихідного рівня) і не відображає частоту повідомлень про побічне явище.
ґ Наприклад крововилив у кон’юнктиву, сітківку, внутрішньоочний крововилив.
д Наприклад носова кровотеча, кровохаркання.
е Наприклад кровотеча з ясен, ректальна кровотеча, кровотеча з виразки шлунка.
є Наприклад екхімоз, крововилив у шкіру, петехії.
ж Наприклад гемартроз, крововилив у м’яз.
з Наприклад гематурія, геморагічний цистит.
и Наприклад вагінальна кровотеча, гематоспермія, постменопаузна кровотеча.
і Наприклад забиття, травматична гематома, травматична кровотеча.
ї Тобто спонтанні, пов’язані з процедурою або травматичні внутрішньочерепні крововиливи.
Опис окремих побічних реакцій
Кровотечі
Випадки кровотеч у дослідженні PLATO
Загальні результати щодо частоти кровотеч у дослідженні PLATO наведено в таблиці 4.
Таблиця 4. Аналіз загальної кількості випадків кровотеч, оцінка за методом Каплана – Мейера за 12 місяців (PLATO)
Тикагрелор, 90 мг двічі на добу N = 9235 |
Клопідогрель N = 9186 |
p-значення* |
|
Великі кровотечі за критеріями PLATO |
11,6 |
11,2 |
0,4336 |
Великі летальні/загрозливі для життя кровотечі за критеріями PLATO |
5,8 |
5,8 |
0,6988 |
Не пов’язані з АКШ великі кровотечі за критеріями PLATO |
4,5 |
3,8 |
0,0264 |
Не пов’язані з процедурами великі кровотечі за критеріями PLATO |
3,1 |
2,3 |
0,0058 |
Великі + малі кровотечі за критеріями PLATO |
16,1 |
14,6 |
0,0084 |
Не пов’язані з процедурами великі + малі кровотечі за критеріями PLATO |
5,9 |
4,3 |
<0,0001 |
Великі кровотечі за критеріями TIMI |
7,9 |
7,7 |
0,5669 |
Великі + малі кровотечі за критеріями TIMI |
11,4 |
10,9 |
0,3272 |
Визначення типу кровотеч:
Великі летальні/загрозливі для життя кровотечі: клінічно виражена, зі зниженням рівня гемоглобіну > 50 г/л чи переливанням ≥ 4 одиниць еритроцитарної маси або летальна, або внутрішньочерепна, або внутрішньосерцева з тампонадою серця, або з гіповолемічним шоком чи тяжкою артеріальною гіпотензією, що потребує застосування вазопресорних лікарських засобів чи хірургічного втручання.
Інші великі кровотечі: клінічно виражена, зі зниженням рівня гемоглобіну на 30–50 г/л чи переливанням 2–3 одиниць еритроцитарної маси або така, що призводить до стійкої втрати дієздатності.
Малі кровотечі: потребують медичного втручання для зупинки або обробки кровотечі.
Великі кровотечі за критеріями TIMI: клінічно виражені, зі зниженням рівня гемоглобіну > 50 г/л або ВЧК.
Малі кровотечі за критеріями TIMI: клінічно виражені, зі зниженням рівня гемоглобіну на 30 –50 г/л.
* p-значення, розраховане за допомогою моделі пропорційних ризиків Кокса, для групи лікування як виключно дослідницький показник.
Тикагрелор і клопідогрель не відрізнялися частотою великих летальних/загрозливих для життя кровотеч за критеріями PLATO, загальною кількістю великих кровотеч за критеріями PLATO, частотою великих або малих кровотеч за критеріями TIMI. Однак частота комбінованих PLATO великих і малих кровотеч була вищою в групі тикагрелору порівняно із групою клопідогрелю. Декілька пацієнтів у дослідженні PLATO мали летальні кровотечі: 20 (0,2 %) у групі тикагрелору та 23 (0,3 %) у групі клопідогрелю (див. розділ «Особливості застосування»).
Вік, стать, маса тіла, расова належність пацієнта, географічний регіон його мешкання, супутні стани, одночасне лікування та медичний анамнез, у тому числі перенесені інсульт або ТІА, не були прогностичними факторами для загальної частоти кровотеч або частоти великих кровотеч у дослідженні PLATO, не пов’язаних з процедурами. Отже, жодна група не була визначена як група підвищеного ризику кровотечі якогось типу.
Кровотечі, пов’язані з АКШ: у дослідженні PLATO 42 % із 1584 пацієнтів (12 % когорти), які пройшли процедуру аортокоронарного шунтування (АКШ), перенесли велику летальну/загрозливу для життя кровотечу за критеріями дослідження PLATO, при цьому була відсутня статистична різниця між терапевтичними групами. У 6 пацієнтів із кожної групи лікування сталася летальна кровотеча, пов’язана з АКШ (див. розділ «Особливості застосування»).
Кровотечі, не пов’язані з АКШ, і кровотечі, не пов’язані з процедурами: тикагрелор і клопідогрель не відрізнялися за частотою не пов’язаних з АКШ летальних/загрозливих для життя великих кровотеч за критеріями дослідження PLATO, але загальна частота великих кровотеч за критеріями PLATO, частота великих кровотеч за критеріями ТІМІ та загальна частота великих і малих кровотеч за критеріями TIMI були вищими у групі лікування тикагрелором. Аналогічно, якщо вилучити усі пов’язані з процедурами кровотечі, то їхня частота була вищою у групі тикагрелору порівняно з групою клопідогрелю (таблиця 5). Припинення лікування через кровотечі, не пов’язані з процедурами, відбувалось частіше в групі лікування тикагрелором (2,9 %), ніж клопідогрелем (1,2 %; p < 0,001).
Внутрішньочерепний крововилив: при застосуванні тикагрелору було більше ВЧК, не пов’язаних з процедурами (n = 27 кровотеч у 26 пацієнтів, 0,3 %), ніж при застосуванні клопідогрелю (n = 14 кровотеч, 0,2 %), з яких 11 кровотеч у групі тикагрелору і 1 кровотеча у групі клопідогрелю були летальними. Різниці у загальній частоті летальних кровотеч не було.
Випадки кровотеч у дослідженні PEGASUS
Загальні результати щодо частоти кровотеч у дослідженні PEGASUS наведено в таблиці 5.
Таблиця 5. Аналіз загальної кількості випадків кровотеч, оцінка за методом Каплана – Мейера за 36 місяців (PEGASUS)
Тикагрелор, 60 мг двічі на добу + АСК N = 6958 |
Тільки АСК N = 6996 |
|||
% КМ |
Співвідношення ризиків (95 % ДІ) |
% КМ |
|
|
Типи кровотеч за критеріями TIMI |
||||
Великі кровотечі за критеріями TIMI |
2,3 |
2,32 (1,68; 3,21) |
1,1 |
< 0,0001 |
Фатальні кровотечі |
0,3 |
1,00 (0,44; 2,27) |
0,3 |
1,0000 |
ВЧК |
0,6 |
1,33 (0,77; 2,31) |
0,5 |
0,3130 |
Інші великі кровотечі за критеріями TIMI |
1,6 |
3,61 (2,31; 5,65) |
0,5 |
< 0,0001 |
Великі + малі кровотечі за критеріями TIMI |
3,4 |
2,54 (1,93; 3,35) |
1,4 |
< 0,0001 |
Великі або малі кровотечі за критеріями TIMI або такі, що потребують медичної допомоги |
16,6 |
2,64 (2,35; 2,97) |
7,0 |
< 0,0001 |
Типи кровотеч за критеріями PLATO |
||||
Великі кровотечі |
3,5 |
2,57 (1,95; 3,37) |
1,4 |
< 0,0001 |
Летальні/загрозливі для життя кровотечі |
2,4 |
2,38 (1,73; 3,26) |
1,1 |
< 0,0001 |
Інші великі кровотечі |
1,1 |
3,37 (1,95; 5,83) |
0,3 |
< 0,0001 |
Великі + малі кровотечі |
15,2 |
2,71 (2,40; 3,08) |
6,2 |
< 0,0001 |
Визначення типу кровотеч:
Великі кровотечі за критеріями TIMI: летальна кровотеча або будь-який вид ВЧК, або крововилив, що супроводжується клінічними проявами, пов’язаний із падінням рівня гемоглобіну (Гб) ≥ 50 г/л, або якщо показники рівня Гб недоступні, зі зниженням гематокриту (Гк) на 15 %.
Летальні кровотечі: випадок кровотечі, який безпосередньо призвів до смерті впродовж 7-ми діб.
ВЧК: внутрішньочерепний крововилив.
Інші великі кровотечі за критеріями TIMI: не пов’язані з ВЧК нелетальні великі кровотечі за критеріями TIMI.
Малі кровотечі за критеріями TIMI: клінічно виражені, зі зниженням рівня Гб на 30–50 г/л.
Такі, що потребують медичної допомоги, за критеріями TIMI: потребують втручання або призводять до госпіталізації, або потребують обстеження.
Великі летальні/загрозливі для життя кровотечі за критеріями PLATO: летальні кровотечі або будь-який вид ВЧК, або внутрішньосерцеві кровотечі з тампонадою серця чи з гіповолемічним шоком або гострою артеріальною гіпотензією, які потребують застосування вазопрессорних/інотропних лікарських засобів чи хірургічного втручання, або клінічно виражені, зі зниженням рівня Гб на 50 г/л або переливанням ≥ 4 одиниць еритроцитарної маси.
Інші великі кровотечі за критеріями PLATO: такі, що призводять до стійкої втрати дієздатності, або клінічно виражені, зі зниженням рівня Гб на 30–50 г/л, чи переливанням 2–3 одиниць еритроцитарної маси.
Малі кровотечі за критеріями PLATO: потребують медичного втручання для зупинки або обробки кровотечі.
У дослідженні PEGASUS великі кровотечі (TIMI) частіше спостерігалися у групі лікування тикагрелором у дозі 60 мг двічі на добу, ніж у групі лікування тільки АСК. Підвищення ризику летальних кровотеч не спостерігалося, крім цього, спостерігалося лише незначне підвищення частоти ВЧК у порівнянні з лікуванням тільки АСК. Було декілька випадків летальних кровотеч у дослідженні: 11 (0,3 %) при застосуванні тикагрелору у дозі 60 мг та 12 (0,3 %) при застосуванні тільки АСК. Спостережуване підвищення ризику великих кровотеч (ТІМІ) при застосуванні тикагрелору у дозі 60 мг, було зумовлено насамперед вищою частотою інших великих кровотеч серед яких переважали випадки, віднесені до порушень з боку ШКТ.
Тенденція до збільшення частоти кровотеч, подібна до такої для великих кровотеч за критеріями ТІМІ, спостерігалася також для великих або малих кровотеч за критеріями ТІМІ, та великих кровотеч за критеріями PLATO, а також для великих або малих кровотеч за критеріями PLATO (див. таблицю 5). Передчасне припинення лікування у зв’язку з кровотечами частіше спостерігалося при застосуванні тикагрелору у дозі 60 мг, ніж при застосуванні тільки АСК (6,2 % та 1,5 % відповідно). Більшість цих кровотеч були менш серйозними (класифікованими згідно з ТІМІ як такі, що вимагають медичної допомоги), наприклад: носова кровотеча, утворення синців та гематоми.
Профіль кровотеч при застосуванні тикагрелору в дозі 60 мг був аналогічним в усіх попередньо визначених підгрупах (наприклад за віком, статтю, масою тіла, расовою належністю пацієнта, географічним регіоном його мешкання, супутніми станами, одночасним лікуванням іншими лікарськими засобами та медичним анамнезом) відносно випадків великих за критеріями TIMI, великих або малих за критеріями TIMI та великих за критеріями PLATO кровотеч.
Внутрішньочерепний крововилив (ВЧК): спонтанні ВЧК при застосуванні тикагрелору у дозі 60 мг та при застосуванні тільки АСК спостерігалися з подібною частотою (n = 13, 0,2 % в обох групах лікування). Травматичні та пов’язані з процедурами ВЧК виникали дещо частіше при застосуванні тикагрелору у дозі 60 мг (n = 15, 0,2 %), ніж при лікуванні тільки АСК (n = 10, 0,1 %). Спостерігалося 6 летальних ВЧК при застосуванні тикагрелору в дозі 60 мг та 5 летальних ВЧК при лікуванні тільки АСК. Частота ВЧК була низькою в обох групах лікування, враховуючи значну супутню захворюваність та фактори ризику СС захворювань у досліджуваній популяції.
Задишка
Пацієнти, яких лікували лікарським засобом Альмінда, повідомляли про задишку, відчуття нестачі повітря. У дослідженні PLATO така ПР, як задишка (задишка, задишка у спокої, задишка при фізичному навантаженні, пароксизмальна нічна задишка та нічна задишка), загалом спостерігалася у 13,8 % пацієнтів, яких лікували тикагрелором, та у 7,8 % пацієнтів, яких лікували клопідогрелем. У дослідженні PLATO у 2,2 % пацієнтів, які отримували тикагрелор, та у 0,6 % пацієнтів, які отримували клопідогрель, дослідники вважали задишку пов’язаною з лікуванням, деякі з цих випадків були серйозними (0,14 % у групі тикагрелору; 0,02 % у групі клопідогрелю) (див. розділ «Особливості застосування»). Найчастіше симптоми задишки були легкими або помірними; у більшості випадків повідомлялося про разовий напад, який виник невдовзі після початку лікування.
У порівнянні із пацієнтами, яким застосовують клопідогрель, пацієнти з БА/ХОЗЛ, які отримують тикагрелор, можуть мати підвищений ризик виникнення несерйозних випадків задишки (3,29 % при застосуванні тикагрелору та 0,53 % при застосуванні клопідогрелю) та серйозних випадків задишки (0,38 % при лікуванні тикагрелором та 0,00 % при лікуванні клопідогрелем). В абсолютному вираженні цей ризик був вищим, ніж у загальній популяції дослідження PLATO. Тикагрелор слід з обережністю застосовувати пацієнтам з БА та/або ХОЗЛ в анамнезі (див. розділ «Особливості застосування»).
Приблизно 30 % епізодів задишки минули протягом 7 днів. У дослідження PLATO включали пацієнтів з такими захворюваннями на вихідному рівні, як застійна серцева недостатність, ХОЗЛ або бронхіальна астма; ці пацієнти, а також пацієнти літнього віку мали більшу схильність до розвитку задишки. 0,9 % пацієнтів, які отримували тикагрелор , передчасно припинили лікування досліджуваним лікарським засобом через появу задишки у порівнянні з 0,1 % пацієнтів, які отримували клопідогрель. Вища частота задишки при застосуванні тикагрелору не пов’язана з розвитком нової або погіршенням перебігу наявної хвороби серця або легень (див. розділ «Особливості застосування»). Тикагрелор не впливає на результати дослідження легеневої функції.
У дослідженні PEGASUS задишка спостерігалася у 14,2 % пацієнтів, які отримували тикагрелор у дозі 60 мг двічі на добу, та у 5,5 % пацієнтів, які отримували тільки АСК. Як і в дослідженні PLATO, у більшості випадків задишка була легкою або помірною (див. розділ «Особливості застосування»). Пацієнти, у яких спостерігалася задишка, як правило, були літнього віку і мали задишку, ХОЗЛ або бронхіальну астму на вихідному рівні.
Дані лабораторних досліджень
Підвищення рівня сечової кислоти: у дослідженні PLATO концентрація сечової кислоти підвищилась більше верхньої межі норми у 22 % пацієнтів, які отримували тикагрелор, у порівнянні з 13 % пацієнтів, які отримували клопідогрель. Відповідні показники у дослідженні PEGASUS становили 9,1 %, 8,8 % і 5,5 % при застосуванні тикагрелору у дозі 90 мг, 60 мг і плацебо відповідно. Середній рівень сечової кислоти у сироватці підвищився приблизно на 15 % при застосуванні тикагрелору у порівнянні з приблизно 7,5 % при застосуванні клопідогрелю, а після припинення лікування знизився приблизно на 7 % при застосуванні тикагрелору, але не знизився при застосуванні клопідогрелю. У дослідженні PEGASUS оборотне підвищення середнього рівня сечової кислоти у сироватці на 6,3 % та 5,6 % спостерігалося при застосуванні тикагрелору у дозі 90 мг та 60 мг відповідно у порівнянні зі зниженням на 1,5 % у групі плацебо. У дослідженні PLATO частота подагричного артриту становила 0,2 % при застосуванні тикагрелору та 0,1 % при застосуванні клопідогрелю. Відповідні показники для подагри/подагричного артриту у дослідженні PEGASUS становили 1,6 %, 1,5 % та 1,1 % у групі застосування тикагрелору у дозі 90 мг, 60 мг і групі плацебо відповідно.
Срок годности
Условия хранения
Упаковка
Категория отпуска
Производитель
Местонахождение производителя и его адрес места осуществления деятельности
Источник инструкции
Обратите внимание!
Описание лекарственного средства на этой странице носит исключительно информационный характер. Для того чтобы правильно выбрать препарат для лечения вашего заболевания, обращайтесь к врачу.
Самолечение может повредить вашему здоровью!
ᐉ Онлайн-аптека Подорожник • Заказ лекарств онлайн с доставкой • Сеть аптек по всей Украине не несет ответственности за некорректное использование информации, размещенной на сайте, и возможные негативные последствия этого. Детальнее отказ от ответственности.